浙江大学医学院研究者们揭示了Hsc70通过靶向PD-L1溶酶体降解促进抗肿瘤免疫
来源:生物谷原创 2024-06-09 14:42
该研究阐明了hsc70介导的PD-L1溶酶体降解的分子机制,为肿瘤免疫治疗提供了靶点和治疗策略。
免疫抑制和功能障碍是癌症的标志之一,而重新激活抗肿瘤免疫反应已成为癌症治疗的一个快速发展的领域。pd - 1 / pd - l1免疫检查点抑制(ICI)是一种很有前景的治疗某些类型癌症的临床疗法,但仍有相当比例的患者产生耐药性。PD-L1在与抗体结合后倾向于内化,其中一部分是溶酶体介导的降解,然而,大多数内化的PD-L1可以储存在循环内体中并重新填充到细胞膜上,介导对靶向PD-L1的ICI治疗的抗性。因此,促进溶酶体降解和抑制PD-L1的再循环是克服ICI治疗耐药的一种有希望的方法。CMTM6是一种普遍表达的蛋白,已被证明可以帮助PD-L1再循环回到质膜,CMTM6的缺失促进了PD-L1通过溶酶体降解,但是,PD-L1的溶酶体降解机制尚不清楚。
目前对PD-L1降解的研究多集中在蛋白酶体途径上,对内体溶酶体途径中PD-L1降解的研究较少。Hsc70(热休克蛋白家族A成员8)是一种细胞质伴侣蛋白,在内体微自噬(eMI)和伴侣介导的自噬(CMA)中起重要作用。大约40%的哺乳动物蛋白含有KFERQ-like motif,它可以作为hsc70的底物。hsc70通过CMA与Lamp2a相互作用,直接将货物蛋白传递给溶酶体,或通过其羧基末端盖子结构域与带负电荷的磷脂酰丝氨酸相互作用,从而通过emi将胞质货物内化到核内体。
虽然CMA和eMI具有相似的基序,但它们的底物并不完全重叠,当具有相似KFERQ基序的蛋白质处于半聚集状态时,它们形成高分子量复合物或不能被CMA展开和降解,但它们仍然可以被eMI降解。翻译后修饰也可以决定蛋白质是否被路由到eMI或CMA。最近的一项研究表明,乙酰化的Tau减少了CMA对其的降解,同时促进了eMI对其的参与。近年来,eMI因其潜在的分子机制和潜在的生物学功能而备受关注,eMI作为一种选择性自噬,在生物大分子的降解中起着重要作用,但其研究相对缺乏。因此,研究PD-L1溶酶体降解的机制和调控可以为提高免疫效能提供新的思路。

图片来源:https://doi.org/10.1038/s41467-024-48597-3
近日,来自浙江大学医学院第一附属医院的研究者们在Nat Commun杂志上发表了题为“Hsc70 promotes anti-tumor immunity by targeting PD-L1 for lysosomal degradation”的文章,该研究阐明了hsc70介导的PD-L1溶酶体降解的分子机制,为肿瘤免疫治疗提供了靶点和治疗策略。
针对PD-1/PD-L1通路的免疫检查点抑制已成为治疗癌症的一种强有力的临床策略,但其疗效因各种耐药机制而复杂,产生耐药的原因之一是PD-L1自身在抗体结合后的内化和再循环。抑制溶酶体介导的PD-L1降解对于保持PD-L1再循环回细胞的数量至关重要。
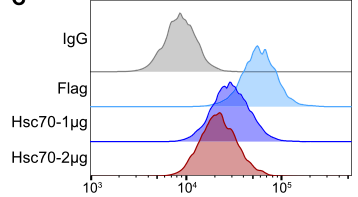
Hsc70通过溶酶体促进PD-L1降解
图片来源:https://doi.org/10.1038/s41467-024-48597-3
在实验中,研究者使用质谱法鉴定Hsc70是主要的pd - l1相互作用蛋白之一,研究发现Hsc70通过内溶体-溶酶体途径促进PD-L1降解,减少PD-L1再循环到细胞膜。这种作用依赖于Hsc70-PD-L1结合,抑制CMTM6-PD-L1相互作用。研究者进一步鉴定了一种Hsp90α/β抑制剂AUY-922,发现它可以诱导Hsc70的表达和PD-L1溶酶体的降解。Hsc70过表达或AUY-922处理均可降低雌性小鼠PD-L1表达,抑制肿瘤生长,促进抗肿瘤T细胞反应,增强抗肿瘤免疫;AUY-922可进一步增强抗pd - l1和抗ctla4治疗的抗肿瘤疗效。该研究阐明了hsc70介导的PD-L1溶酶体降解的分子机制,为未来癌症免疫治疗的发展提供了途径。
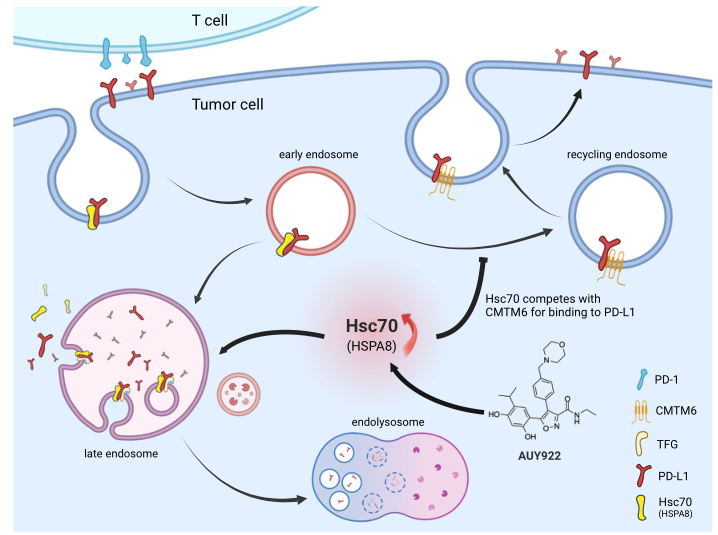
Hsc70通过eMI靶向PD-L1降解促进抗肿瘤免疫的示意图模型
图片来源:https://doi.org/10.1038/s41467-024-48597-3
综上所述,本研究表明,增强Hsc70与底物蛋白(如PD-L1)之间的相互作用可以缓解疾病进展,这些结果还提出了一种可能性,即通过调节蛋白量或修饰Hsc70来调节eMI也可能有益于其他eMI相关疾病,包括癌症、神经退行性疾病和其他与衰老相关的疾病。 (生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


