Nature子刊:陈佺/李艳君团队等揭示血小板激活因子介导铁死亡并导致急性肾损伤的机制
来源:生物世界 2024-02-03 11:47
研究揭示了血小板激活因子(PAF)和PAF样磷脂(PAF-LPL)介导了同步铁死亡,并导致了急性肾损伤(AKI),而血小板激活因子乙酰水解酶2(PAFAH2)能够抑制同步铁死亡以改善急性肾损伤。
南开大学陈佺、李艳君、中国科学技术大学熊伟、朱洪影及浙江大学王勇等人在 Nature Chemical Biology 期刊发表了题为:PAFAH2 suppresses synchronized ferroptosis to ameliorate acute kidney injury 的研究论文。
该研究揭示了血小板激活因子(PAF)和PAF样磷脂(PAF-LPL)介导了同步铁死亡,并导致了急性肾损伤(AKI),而血小板激活因子乙酰水解酶2(PAFAH2)能够抑制同步铁死亡以改善急性肾损伤。

近期的一些研究进展揭示了铁死亡的关键特征是高度选择性和特异性的磷脂酰乙醇胺(PE)过氧化。膜磷脂中酯化多不饱和脂肪酸(PUFA)的ACSL4和LPCAT3酶,以及推动磷脂酰乙醇胺(PE)中PUFA过氧化的15-LOX和POR酶被发现促进铁死亡。
此外,Ca2+非依赖性磷脂酶A2β(iPLA2β)对15-HpETE-PE的水解导致铁死亡底物的消除。这些磷脂氢过氧化物在受到次级自由基攻击和脂肪酰基链自发重排时,可能会在新引入的过氧基(OO·)处断裂,产生大量具有短脂肪酰基残基酯化在亲本磷脂sn-2位点的产物。具有短酰基链的截短氧化磷脂(Tr-oxPL)在结构和功能上类似于血小板激活因子(PAF),这是一种涉及多种病理生理过程的强效磷脂介质,因此它们被恰当地命名为PAF样磷脂(PAF-LPL)。这些截短的过氧化脂肪酸可能会重新定向酰基链并突出到水相区室中,使其可被脂质酶(例如PAFAH2)清除。
该研究报告了血小板激活因子(PAF)和PAF样磷脂(PAF-LPL)介导了同步铁死亡,并导致了急性肾损伤(AKI)。在铁死亡中,PAF和PAF-LPL的出现导致了生物膜的不稳定,并标志着邻近细胞的细胞死亡。这种级联反应可以通过血小板激活因子乙酰水解酶2(PAFAH2)或通过靶向PAF的抗体来抑制。基因敲除或药理学抑制PAFAH2,增加了PAF的产生,增强了同步铁死亡,并加剧了缺血/再灌注(I/R)诱导的急性肾损伤(AKI)。值得注意的是,静脉注射野生型PAFAH2蛋白(而不是无活性的突变体)可以预防同步肾小管细胞死亡、肾单位丢失和急性肾损伤(AKI)。
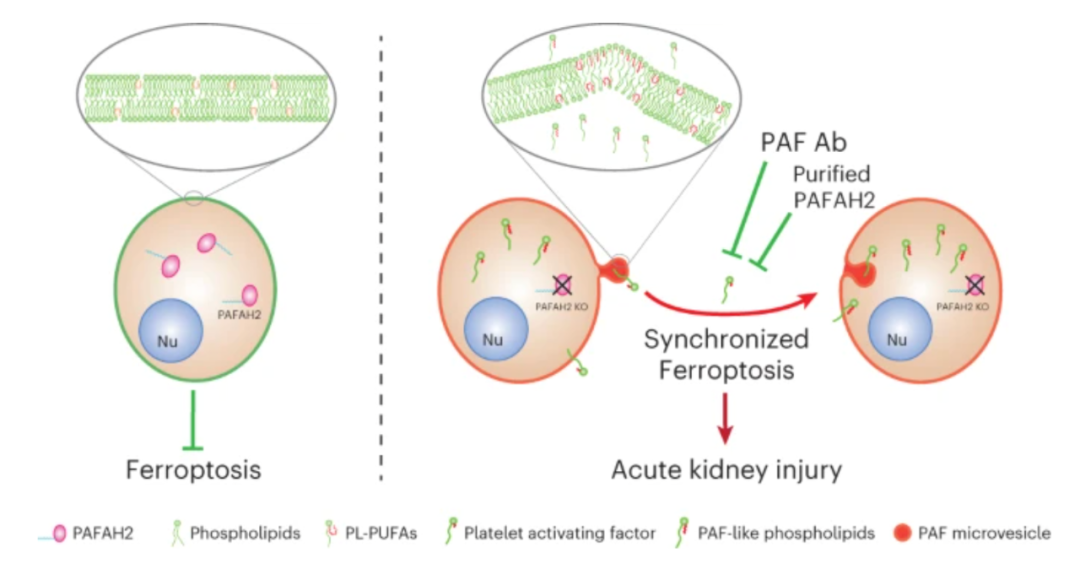
这些研究结果为同步铁死亡的机制提供了新见解,并为急性肾损伤(AKI)的预防干预提供了可能性
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


