Cell Stem Cell:北京大学杜鹏团队利用全能性干细胞实现了早期胚胎发育过程的精准重建
来源:生物世界 2025-01-24 09:46
该研究首次建立了基于 mTBLC 的自发分化和胚胎样结构形成系统,成功模拟了胚胎早期发育的多个关键环节。尤其是在细胞命运决定和全能性研究领域,这一系统为理解早期胚胎发育中的细胞命运转变提供了新的视角。
杜鹏课题组在 Cell Stem Cell 期刊发表了题为:Mouse totipotent blastomere-like cells model embryogenesis from zygotic genome activation to post implantation 的研究论文。
在这项研究中,研究团队进一步优化了 mTBLC 的培养条件,并开发了 mTBLC 自发分化和单细胞起始的类囊胚形成系统,mTBLC-类囊胚具有上胚层(EPI)、原始内胚层(PrE)和胚外滋养层(TE)谱系,并能进一步形成着床后阶段的卵圆柱胚样结构,重现了从 ZGA 至囊胚形成的完整发育过程。这一突破为研究全能性、细胞命运决定以及早期胚胎形态发生提供了新的技术平台,也为早期发育的基础与转化研究开辟了新的可能性。

在这项研究工作中,研究团队主要有以下发现:
1、该研究通过优化培养基(2MYCP),显著提高了 mTBLC 的增殖速度和长期自我更新能力,主要通过加入 2-DG、Minocycline、Y-27632、CHIR-99021 和 PlaB 等因子。在此过程中,PlaB 发挥了关键作用,通过抑制剪接驱动了从多能性向全能性的转变,而 Oct4 基因的去除并未影响 mTBLC 在 2MYCP 培养基中的自我更新能力,表明 Oct4 不是维持细胞全能性的必要条件。2MYCP 培养基中,Wnt 信号通路在 mTBLC 中被激活,且 Wnt 信号通路与细胞周期、增殖通路的激活与 mTBLC 的快速自我更新能力密切相关。进一步的实验结果表明,抑制 Wnt 信号通路可显著抑制 mTBLC 的增殖,证明 Wnt 信号对于 2MYCP 培养基中 mTBLC 的快速扩增至关重要,但它并不参与维持 mTBLC 的全能性。
2、mTBLC 具有独特的表观基因组特征,这些特征有助于其全能性维持和快速自我更新。通过 ATAC-seq 和 CUT&Tag 分析,发现 mTBLC 的启动子区域(TSS)H3K27me3 和 H3K9me3 整体水平下降,而 H3K4me3、H3K27ac 和 RNA Pol II 标记整体水平未发生显著变化,其表观特征与早期胚胎的初期胚胎细胞(如2细胞阶段)相似。此外,mTBLC 具有比 PSC 更多的宽的 H3K4me3 域 (broad domain),以及更少的二价修饰基因(bivalent gene),且 MERVL 转座子在 mTBLC 中具有显著的 H3K4me3 标记。Wnt 信号通路的激活进一步增强了与细胞周期和增殖相关基因的 H3K4me3 富集,从而促进了 mTBLC 的快速增殖。
3、该研究进一步评估了 mTBLC 在体内外的分化潜力。在嵌合体实验中,通过单细胞数据,捕获到了 EGFP 标记的 mTBLC 生成的 13 种细胞,其中包括 7 个胚外谱系和 6 个胚内谱系,证明了其在嵌合小鼠中的双向发育潜能。此外,mTBLC 通过类胚体(EB)和畸胎瘤实验也都展示出了胚内外双向分化潜能,产生了包括神经、心脏和肾脏等三胚层来源的细胞,也激活了包括经典滋养层标志基因,展示其能够生成胚外滋养层样谱系。总体而言,mTBLC 具有强大的双向发育潜力,能够分化为各种胚内外谱系,成为评估全能干细胞发育潜力的重要工具。
4、该研究利用 mTBLC 建立了一个模拟胚胎着床前发育的体外分化模型,以克服现有体外分化系统的挑战。在基础分化培养基中培养 mTBLC 约 3-4 天后,细胞形态发生显著变化,形成了胚胎干细胞(ESC)、胚外内胚层干细胞(XEN)和滋养层干细胞(TSC)样的克隆。RNA-seq 分析显示,mTBLC 在分化过程中激活了不同发育阶段的基因,经历了从早期初级基因组激活(minor ZGA)到主要基因激活(major ZGA)的转变。免疫组化验证了 mTBLC 能够分化为上胚层(EPI)、胚外滋养层(TE)和原始内胚层(PrE)等谱系。单细胞 RNA 测序揭示,mTBLC 在分化过程中产生了涵盖 2 细胞、4 细胞、8 细胞及囊胚阶段的多种细胞类型,拟时间分析显示 mTBLC 经历了两次命运决定,首次产生 TE 样细胞和 ICM/EPI 样细胞,随后 ICM/EPI 样细胞分化产生了 PrE 样细胞。
研究进一步发现,在自发分化过程中,mTBLC 还产生了 Zscan4+ 和 Zscan4- 两类基因组激活样细胞(ZLC)。拟时间分析表明,只有 Zscan4- ZLC 能够成功分化为 EPI、PrE 和 TE 三大谱系。因此,该研究提出,主要的 ZGA 调控网络可能至少可以分为由 Zscan4 表达标记的两个独立部分。同时,Zscan4 的表达可能并不是进一步干细胞命运决定所必需的。这一观察结果也与人类 TBLC 的自发分化过程一致,在这一过程中,经典的 ZGA 标志基因(如 ZSCAN4/5A、DUXA/B 和 TPRX1 等)完全没有被诱导表达。这些发现不仅进一步证实了 mTBLC 的内在全能性,也为探索哺乳动物胚胎发育过程中的共性机制提供了新视角。
5、研究还发现,在没有任何外源性信号干预的情况下,单个 mTBLC 能够经历扩增、极化和压实过程,最终高效率地形成结构完整的类囊胚(blastoid)。这一类囊胚结构不仅包含内细胞团、原始内胚层和滋养外胚层等胚胎样细胞,且未见异常中间状态的细胞,mTBLC 来源的囊胚在转录组上与体内囊胚更为接近,三个谱系的特定标志物富集。并且类囊胚可以在体外继续培养,发育成类似卵圆柱的后植入阶段结构。也可以将类囊胚移植到假孕小鼠中,其成功植入并形成卵圆柱样着床后胚胎结构。
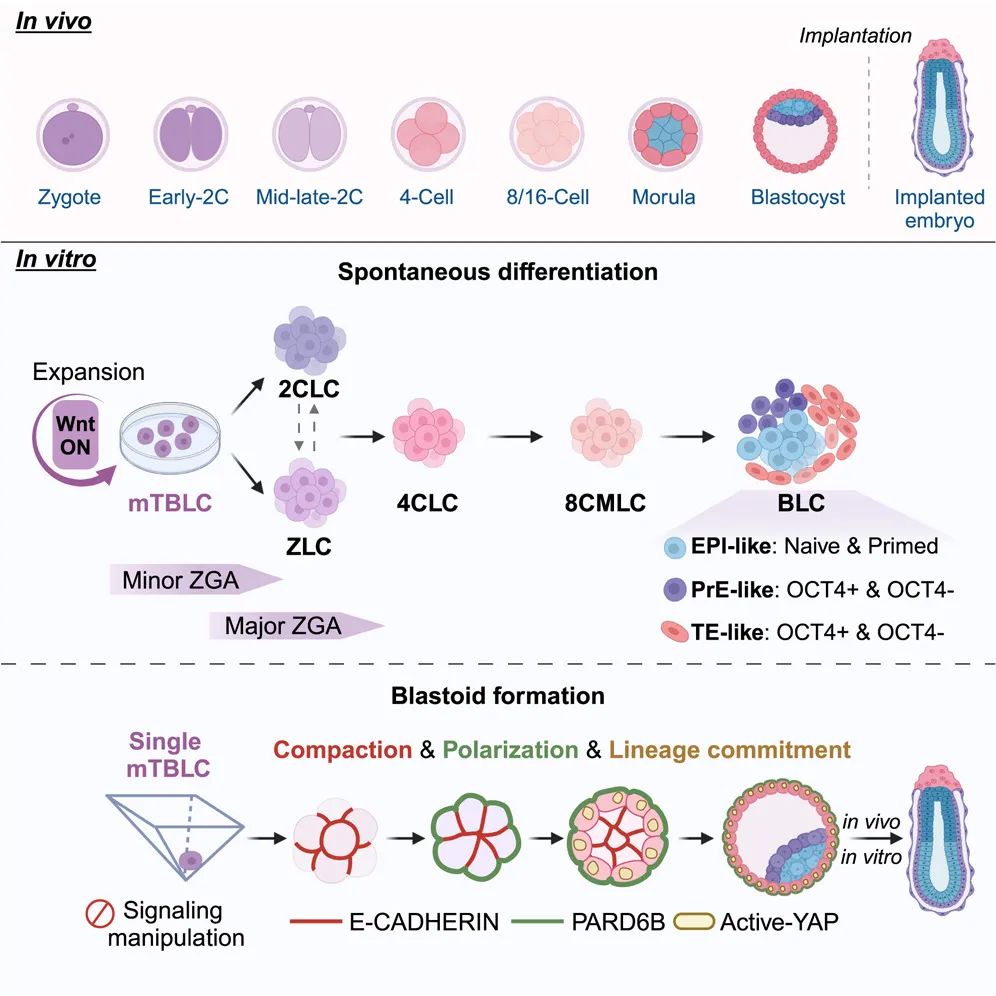
综上,该研究首次建立了基于 mTBLC 的自发分化和胚胎样结构形成系统,成功模拟了胚胎早期发育的多个关键环节。尤其是在细胞命运决定和全能性研究领域,这一系统为理解早期胚胎发育中的细胞命运转变提供了新的视角。此外,该研究还为胚胎发育模型的应用开辟了新的可能性,未来基于这一系统,科学家们有望深入研究胚胎发育异常的分子机制,探索病理过程,甚至为解决不孕不育等生育医学问题提供全新解决方案。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


