STTT | 浙江大学欧阳宏伟/周婧发现创伤后关节损伤合并关节出血(关节积血)表现出更差的肝功能
来源:生物探索 2024-05-17 14:00
该研究揭示了由基质蛋白激活的CD4+T细胞介导的病理性关节-肝轴,该轴刷新了器官串扰轴,并为关节积血相关疾病提供了新的治疗靶点。
浙江大学欧阳宏伟及周婧共同通讯在Signal Transduction and Targeted Therapy 发表题为“A pathological joint–liver axis mediated by matrikine-activated CD4+ T cells”的研究论文,研究临床数据显示,与健康对照组相比,创伤后关节损伤合并关节出血(关节积血)表现出更差的肝功能。在小鼠模型中,关节积血可诱导软骨变性和远程肝损伤。接下来,该研究发现关节积血诱导外周血和脾脏中CD4+T细胞对Th17细胞的比例和分化上调。
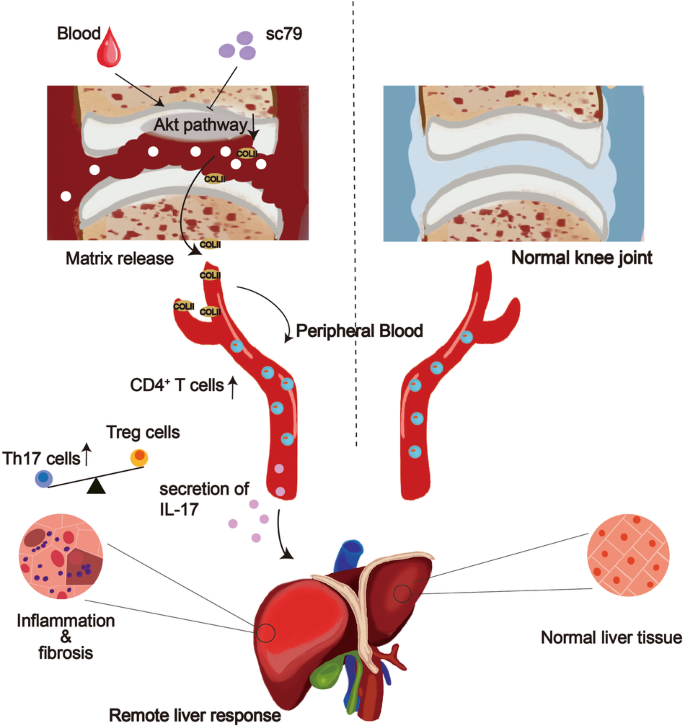
CD4+ T细胞的缺失可逆转关节积血诱导的肝损伤。关节积血诱导的软骨基质变性上调血清学II型胶原(COL II),从而激活 CD4+T细胞。全身应用COL II抗体可阻断活化。此外,大量RNAseq和单细胞qPCR分析显示,软骨Akt通路受到血液处理的抑制。关节内应用Akt激活剂可阻断软骨变性,从而防止小鼠和猪模型的肝损伤。综上所述,该研究揭示了由基质蛋白激活的CD4+T细胞介导的病理性关节-肝轴,该轴刷新了器官串扰轴,并为关节积血相关疾病提供了新的治疗靶点。
创伤后骨关节炎(OA)发生在创伤后关节损伤后,占所有症状性骨关节炎病例的12%。关节内(IA)关节出血(关节积血)在创伤后关节损伤的病理生理学中起重要作用。此外,关节积血会导致血友病和全膝关节置换术患者的严重关节损伤和不稳定。关节软骨的内源性修复能力较差,而IA血液可直接或通过关节微环境导致软骨退化。
关节积血后,铁沉积在滑膜的浅表层和滑膜下层,导致滑膜增生和肥大,纤维化,新生血管形成。血液处理的滑膜增加促炎细胞因子的分泌以及基质降解蛋白酶,以破坏关节微环境和软骨。此外,软骨破坏因素可以在血液处理的软骨本身中诱导红细胞衍生的铁可通过产生羟基自由基导致软骨细胞直接凋亡。尽管这些微环境因素已得到证实,但对关节积血环境中软骨组织信号转导的改变知之甚少。
最近,体内各种远处器官和组织之间的串扰得到了广泛的研究。之前的研究发现,植入腹壁的生物材料会导致肝脏脂肪沉积;皮肤炎症性疾病会导致炎症性肠病。由于膝关节具有半月板和滑膜的结构,封闭关节腔,而关节软骨具有无血管和神经性质,因此膝关节被视为一个封闭系统。软骨损伤与远处器官反应之间的串扰尚不清楚。然而,先前的研究发现了一些血清学生物标志物,其水平在血友病关节病和 OA 的关节损伤期间显著增加。
模式图(Credit: Signal Transduction and Targeted Therapy)
值得注意的是,实体器官可以受到外周血中可溶性ECM(也称为基质素)的影响。此外,可溶性ECM可以诱导免疫反应和免疫细胞活化。例如,可溶性硫酸乙酰肝素(HS)的释放有助于外周单核细胞和脾细胞分泌促炎因子。由于过度炎症可导致组织损伤,外周血中的可溶性ECM可能通过激活免疫反应来诱导实体器官反应。
在特异性可溶性ECM、免疫应答和远处器官损伤方面,COL II是软骨的主要结构蛋白,同时研究发现血友病患者血清中可溶性COL II(sCOL II)上调和 OA。然而,关节损伤诱导的血清学 COL II 上调的生物学效应仍然未知。辅助性T细胞(CD4+T)可以被几种自产成分激活,并参与自身免疫性疾病。抗原加工细胞和/或炎症微环境引导的CD4+T细胞功能障碍会导致肝脏炎症、纤维化和脂肪肝疾病。因此,CD4+T细胞有可能在关节病期间被自产的sCOL II激活,然后引起肝脏疾病。
该研究收集了创伤后关节损伤、原发性 OA 和正常关节患者的数据,揭示了肝脏和关节之间遭受创伤的串扰。使用关节积血的小鼠模型,解释了病理性的关节-肝轴。关节积血通过抑制软骨Akt通路诱导软骨变性和 COL II 释放。软骨释放的II型胶原激活CD4+ T细胞,导致肝脏损伤。这些发现刷新了体内的器官串音现象,为关节积血相关疾病的治疗提供了新的靶点。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


