Nature Aging:香港科技大学叶玉如团队揭示小胶质细胞通过VCAM1-ApoE通路识别和清除Aβ,减轻阿尔茨海默病病理
来源:生物世界 2023-10-10 13:29
该研究发现,IL-33在小胶质细胞中诱导VCAM1表达,这促进了小胶质细胞向β-淀粉样蛋白(Aβ)斑块相关ApoE的趋化,并导致Aβ的清除。
近日,香港科技大学校长叶玉如院士团队在 Nature Aging 期刊发表了题为:The VCAM1–ApoE pathway directs microglial chemotaxis and alleviates Alzheimer’s disease pathology 的研究论文。
该研究发现,IL-33在小胶质细胞中诱导VCAM1表达,这促进了小胶质细胞向β-淀粉样蛋白(Aβ)斑块相关ApoE的趋化,并导致Aβ的清除。功能筛选发现VCAM1通过感知Aβ斑块相关ApoE来指导小胶质细胞的Aβ趋化。此外,该研究发现,破坏VCAM1-ApoE相互作用会破坏小胶质细胞的Aβ趋化,导致小胶质细胞清除Aβ的能力下降。此外,研究团队还在阿尔茨海默病患者中发现,较高的脑脊液可溶性VCAM1水平与受损的小胶质细胞Aβ趋化相关。
这些研究结果揭示了Aβ斑块相关ApoE的意想不到的作用——作为一种化学诱导剂来指导小胶质细胞的迁移。这项研究首次表明,小胶质细胞受体和Aβ斑块相关因子之间的相互作用控制着小胶质细胞中的Aβ趋化性,并导致Aβ的清除。这些发现也提示了促进依赖于VCAM1-ApoE的小胶质细胞功能可以改善阿尔茨海默病病理。

在DAMP清除过程中,小胶质细胞在功能状态之间转换时,改变其感受器受体表达谱。在Aβ聚集的反应中,小胶质细胞采取吞噬细胞表型,并表达疾病相关小胶质细胞(DAM)的基因特征,以感受器受体(Axl和Trem2)表达增加为标志。
遗传分析进一步表明,这些感受器受体对调控阿尔茨海默病的发病机制非常重要。特别是,许多阿尔茨海默病风险基因突变位于编码感受器受体的基因编码序列附近或其中,包括CD33和TREM2。 这些突变降低了小胶质细胞吞噬清除能力,DAMP周围的屏障形成,并通过改变各自感受器受体的表达、功能或切割,加剧了阿尔茨海默病发病。 有趣的是,一些感受器受体,例如TREM2,可以以阶段依赖性的方式调控小胶质细胞功能和阿尔茨海默病病理。因此,需要进一步研究这些感受器及其功能障碍如何调控小胶质细胞的功能,并促进阿尔茨海默病的发病。
在小胶质细胞的DAMP清除过程中,感受器受体是如何被调控并与DAMP相互作用以控制特定功能(包括趋化和吞噬)的,这在很大程度上仍然是未知的。小胶质细胞的DAMP清除的诱导在体内是随机的,部分原因是Aβ沉积以时空随机的方式发展。这阻碍了对小胶质细胞在DAMP清除过程中的不同功能状态及其调控机制的详细研究。
而叶玉如团队之前的研究表明,白细胞介素-33(IL-33)以一种时间上精确的方式促进小胶质细胞对Aβ的清除。通过进行双光子活体成像和流式细胞术分析,研究团队发现在APP/PS1小鼠(淀粉样变性小鼠模型)中,小胶质细胞首先表现出Aβ趋化(3–12h后),随后吞噬Aβ(15–24h后)。
在这项最新研究中,叶玉如团队进一步探索了在APP/PS1小鼠中,IL-33治疗后感受器受体及其与其配体的相互作用是如何调控小胶质细胞对DAMP的清除。解决这些知识空白将为阿尔茨海默病中感受器受体-配体相互作用在小胶质细胞的DAMP清除中的作用提供重要见解。
该研究证明了小胶质细胞中趋化蛋白VCAM1的诱导增强了它们与同源配体ApoE的相互作用,从而驱动Aβ趋化和随后的Aβ清除。单细胞转录组学和谱系发育分析表明,在IL-33治疗的APP/PS1小鼠中,小胶质细胞在转变为Aβ吞噬状态之前,它们采用了一种趋化状态,在这种状态下,它们表现出Aβ导向的迁移。此外,功能筛选发现,VCAM1通过感知Aβ斑块中的ApoE来调控小胶质细胞向Aβ斑块的趋化。在IL-33治疗后,VCAM1-ApoE相互作用的阻断抑制了小胶质细胞的Aβ趋化和它们随后向吞噬小胶质细胞分化。
此外,在阿尔茨海默病患者的大脑中,VCAM1信号被抑制,并与小胶质细胞向Aβ斑块的迁移受损相关。
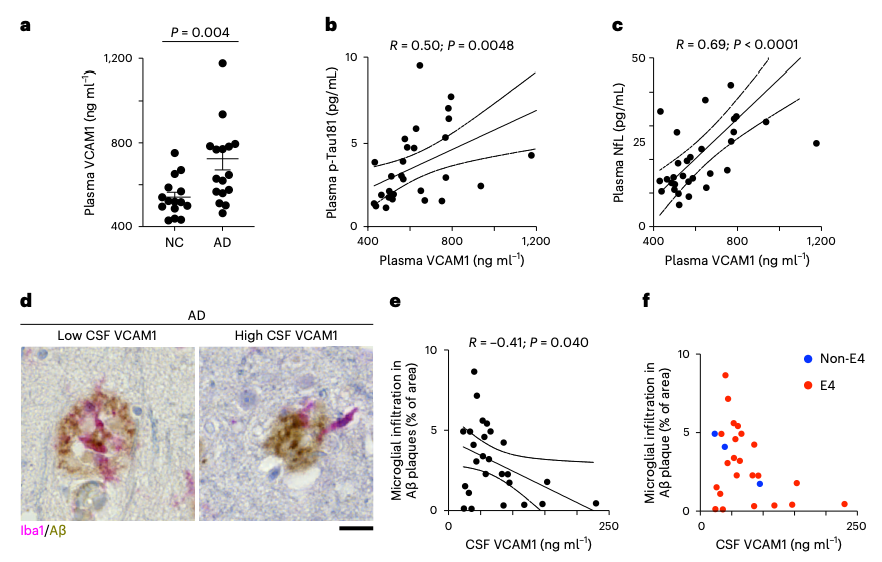
在阿尔茨海默病患者中,VCAM1信号失调与小胶质细胞浸润Aβ斑块受损有关
总的来说,这些发现证明了VCAM1-ApoE通路对于促进小胶质细胞向Aβ斑块的趋化和减轻淀粉样病变很重要。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


