Science:反常!一种淀粉样蛋白非但不致病,而且还有助于储存记忆
来源:本站原创 2020-03-20 22:05
2020年3月20日讯/生物谷BIOON/---人们已知一种称为胞质聚腺苷酸化元件结合蛋白(CPEB)的mRNA结合蛋白与长期记忆存储相关联。Orb2是CPEB蛋白的果蝇版本。在一项新的研究中,来自美国斯托瓦斯医学研究所、华盛顿大学和堪萨斯大学医学中心的研究人员首次描述了一种内源性的功能性神经元淀粉样蛋白在原子分辨率下的结构。这种淀粉样蛋白由Orb2蛋白自聚
2020年3月20日讯/生物谷BIOON/---人们已知一种称为胞质聚腺苷酸化元件结合蛋白(CPEB)的mRNA结合蛋白与长期记忆存储相关联。Orb2是CPEB蛋白的果蝇版本。在一项新的研究中,来自美国斯托瓦斯医学研究所、华盛顿大学和堪萨斯大学医学中心的研究人员首次描述了一种内源性的功能性神经元淀粉样蛋白在原子分辨率下的结构。这种淀粉样蛋白由Orb2蛋白自聚集而成。这些研究结果可能产生一些非常有趣的影响。相关研究结果近期发表在Science期刊上,论文标题为“Cryo-EM structure of a neuronal functional amyloid implicated in memory persistence in Drosophila”。
论文通讯作者、斯托瓦斯医学研究所研究员Kausik Si博士说,“我们认为当一种蛋白由于某种原因变坏或错误折叠时,淀粉样蛋白通常就会产生,这提示着淀粉样蛋白在一种随机的、不受控制的过程中形成。相反,我们发现淀粉样蛋白可以在特定时间和特定细胞中以特定方式形成。”
淀粉样蛋白通常是在与它们相关的神经毒性或退行性状态的背景下理解的。就阿尔茨海默病、帕金森病、亨廷顿舞蹈病和克雅氏病(Creutzfeldt-Jakob disease)而言,蛋白以异常方式聚集而形成稳定的不可溶性沉积物,从而对神经系统造成严重破坏。
然而,在2003年,Si及其当时的导师Eric Kandel博士在研究海蜗牛(Aplysia californica)中的CPEB蛋白时,发现了在神经系统中存在具有适应功能的淀粉样蛋白。通过在小鼠和果蝇中开展后续研究,Si和其他人发现了事实上,CPEB和Orb2蛋白自聚集物(即淀粉样蛋白)的独特特性对于它们在突触中发挥正常功能至关重要。
这些研究已表明CPEB/Orb2在大脑中以不同的功能和结构状态存在。它的一种主要形式是抑制突触中蛋白翻译的单体,但是随着记忆的形成,这些单体自组装成促进突触中蛋白翻译的生化活性聚集物。这一转换对于记忆持久性是必需的。
论文第一作者、Si实验室研高级研究助理Ruben Hervas博士说,“他们推测淀粉样蛋白状态可能很重要,但是在这项新的研究之前,还没有确切证据表明这种蛋白的物理状态是淀粉样蛋白。”
Hervas在研究生院期间研究了引起疾病的淀粉样蛋白。他说,“我想利用我的生物物理学背景来研究其他形成淀粉样蛋白的蛋白的结构特征。”
在Hervas于2016年加入Si实验室后,他和Si早就同意研究Orb2结构的最佳方法是使用内源性蛋白(来自许多果蝇),而不是使用从细菌中提取的重组Orb2,尽管这样要困难得多。
Hervas解释说,与内源性Orb2不同,重组Orb2不具有生物化学活性。“原始环境,即神经系统,对于保持这种蛋白的活性构象及其最有趣的特性非常重要-与它的自聚集和形成与记忆相关的生化活性淀粉样蛋白结构有关。”
Hervas及其团队面临另一个障碍。“由于这种蛋白很大,大约有700个氨基酸,所以它不易结晶。比如,到目前为止,通过X射线晶体学解析出的淀粉样蛋白结构只使用了由很少氨基酸组成的肽。”因此,Hervas继续说,“低温电镜提供了解析这类蛋白结构的机会。”
在这项新的研究中,Hervas及其同事们从大约300万个成年果蝇头部中纯化出Orb2。在这些样品中,Orb2以单体、低聚物或自聚集丝(即淀粉状蛋白)形式存在。这些研究人员首先证实Orb2自聚集丝能够促进更多的自聚集丝形成,并且这些纯化的Orb2形式具有生化活性:在单体状态下能够抑制蛋白翻译,而在低聚物和自聚集丝状态下能够激活蛋白翻译。
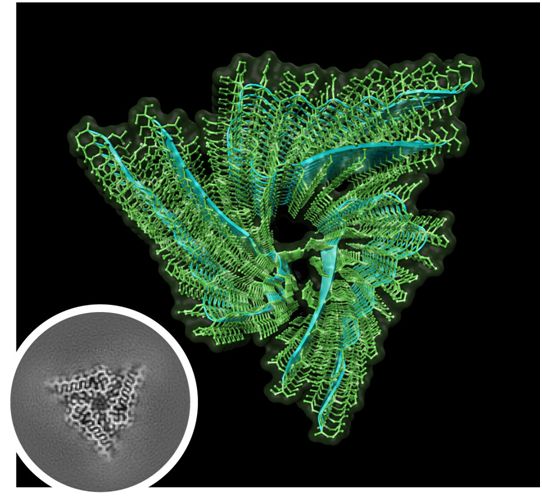
他们的艰苦努力获得了回报。通过使用低温电镜和纯度超过97%的样品,Hervas及其同事们能够在2.6埃的分辨率下解析出内源性果蝇Orb2的结构。他们发现内源性Orb2形成了大约75纳米长的三重对称淀粉样蛋白丝。他们证实Orb2在交叉β淀粉样蛋白结构中聚集,并发现它的原丝核心的发夹状折叠(由31个氨基酸组成)通过亲水性界面堆积。
这项研究还为一个非常重要的问题---淀粉样蛋白通常与记忆丧失相关,然而一种神经元蛋白的淀粉样蛋白形式如何可能有助于存储记忆?---提供了部分答案。在这篇论文中,这些研究人员得出结论:与病原性淀粉样蛋白的疏水核心不同,Orb2自聚集丝的亲水性核心提示着某些神经元淀粉样蛋白如何可能成为稳定但可调节的记忆底物。
Si说,“这一发现改变了我们对蛋白折叠和组装的思考方式。我们如今对生物学的看法是:你拥有一个基因,你可以制造一串氨基酸,而且一旦一个多肽被制造出来,它就被设定成一种构象,这是因为它具有特定的功能。如果它偏离了这条路径,系统就会移除它。但是这项研究提示着细胞有时可以使得相同的蛋白形成完全不同的构象。它是怎么做到的?它什么时候这样做呢?”
某些蛋白的构象柔韧性打开了一种可能性,即一种蛋白可能具有多种功能,这取决于构象状态:Si及其实验室成员将热衷于研究这一现象。
虽然果蝇的记忆测试具有参考价值,但是Hervas和他的同事们接下来期待确定这样的功能性淀粉样蛋白是否也存在于小鼠和人类的神经系统中,特别是因为人类的神经系统特别容易受到淀粉样蛋白相关疾病的影响。
Hervas解释说,在小鼠和人类中,有四种CPEB亚型,每一种亚型都有几种变体。“小鼠中的某些特定亚型对于记忆整合也很重要,它们的蛋白序列与相应的人类CPEB亚型几乎相同。”
“我们开始研究从人类颞叶内侧---一种保持长久记忆的大脑结构---中提取的CPEB蛋白。我们打算解析出这种蛋白的结构,然后可能使用小鼠模型在记忆与蛋白结构之间建立关联性。”
Si反映说,“随着生物变得更加复杂,大脑是进化和多样化最多的系统之一。但是,如果研究一下所涉及的蛋白数量,那么这实际上并没有发生很大变化。一种可能性是,更复杂的生物系统利用这种构象空间来创造更多的功能。与其构建新的蛋白,还不如通过呈现不同的形状来产生新的功能。”
研究发现总结
蛋白通常被认为呈现单一形状,而蛋白的形状决定它的功能。但是,某些蛋白在自组装时可以采用次级形状,即“淀粉样蛋白”形式。从历史上看,淀粉样蛋白被认为是无功能的,甚至是引起疾病的原因,特别是在大脑中,就像阿尔茨海默病中的那样。
不过,令人吃惊的是,Si博士等人的研究已表明长期记忆的形成和持久存在所必需的蛋白Orb2可能会呈现淀粉样蛋白的形状作为它的正常和必要功能的一部分。但是,在此之前,人们还没有确定Orb2是否以真正的淀粉样蛋白形式存在于大脑中,这是因为它的结构是未知的。
这些研究人员解析出从天然来源(数百万个果蝇的大脑)中纯化出的Orb2在原子分辨率下的结构,并证实它确实以功能性淀粉样蛋白的形式存在于大脑中。这项研究是首次从大脑中纯化和在结构上描述一种具有已知生物学功能的淀粉样蛋白。有趣的是,Orb2的淀粉样蛋白形式促进了记忆相关蛋白的产生,而Orb2的单体形式抑制记忆相关蛋白的产生,这表明一种蛋白可以通过呈现多种形状来发挥多种功能。
这些发现提出了两个有趣的可能性,将在Si实验室中进一步探讨:一种可能性就是这样的功能性神经元淀粉样蛋白是否也可能也存在于人类中;另一种可能性就是已知具有特定功能的其他蛋白是否可能呈现淀粉样蛋白形状以实现备用功能。(生物谷 Bioon.com)
参考资料:
1.Ruben Hervas et al. Cryo-EM structure of a neuronal functional amyloid implicated in memory persistence in Drosophila. Science, 2020, doi:10.1126/science.aba3526.
2.How the historically misunderstood amyloid helps to store memories
https://medicalxpress.com/news/2020-03-historically-misunderstood-amyloid-memories.html

图片来自Si Lab, Stowers Institute for Medical Research。
论文通讯作者、斯托瓦斯医学研究所研究员Kausik Si博士说,“我们认为当一种蛋白由于某种原因变坏或错误折叠时,淀粉样蛋白通常就会产生,这提示着淀粉样蛋白在一种随机的、不受控制的过程中形成。相反,我们发现淀粉样蛋白可以在特定时间和特定细胞中以特定方式形成。”
淀粉样蛋白通常是在与它们相关的神经毒性或退行性状态的背景下理解的。就阿尔茨海默病、帕金森病、亨廷顿舞蹈病和克雅氏病(Creutzfeldt-Jakob disease)而言,蛋白以异常方式聚集而形成稳定的不可溶性沉积物,从而对神经系统造成严重破坏。
然而,在2003年,Si及其当时的导师Eric Kandel博士在研究海蜗牛(Aplysia californica)中的CPEB蛋白时,发现了在神经系统中存在具有适应功能的淀粉样蛋白。通过在小鼠和果蝇中开展后续研究,Si和其他人发现了事实上,CPEB和Orb2蛋白自聚集物(即淀粉样蛋白)的独特特性对于它们在突触中发挥正常功能至关重要。
这些研究已表明CPEB/Orb2在大脑中以不同的功能和结构状态存在。它的一种主要形式是抑制突触中蛋白翻译的单体,但是随着记忆的形成,这些单体自组装成促进突触中蛋白翻译的生化活性聚集物。这一转换对于记忆持久性是必需的。
论文第一作者、Si实验室研高级研究助理Ruben Hervas博士说,“他们推测淀粉样蛋白状态可能很重要,但是在这项新的研究之前,还没有确切证据表明这种蛋白的物理状态是淀粉样蛋白。”
Hervas在研究生院期间研究了引起疾病的淀粉样蛋白。他说,“我想利用我的生物物理学背景来研究其他形成淀粉样蛋白的蛋白的结构特征。”
在Hervas于2016年加入Si实验室后,他和Si早就同意研究Orb2结构的最佳方法是使用内源性蛋白(来自许多果蝇),而不是使用从细菌中提取的重组Orb2,尽管这样要困难得多。
Hervas解释说,与内源性Orb2不同,重组Orb2不具有生物化学活性。“原始环境,即神经系统,对于保持这种蛋白的活性构象及其最有趣的特性非常重要-与它的自聚集和形成与记忆相关的生化活性淀粉样蛋白结构有关。”
Hervas及其团队面临另一个障碍。“由于这种蛋白很大,大约有700个氨基酸,所以它不易结晶。比如,到目前为止,通过X射线晶体学解析出的淀粉样蛋白结构只使用了由很少氨基酸组成的肽。”因此,Hervas继续说,“低温电镜提供了解析这类蛋白结构的机会。”
在这项新的研究中,Hervas及其同事们从大约300万个成年果蝇头部中纯化出Orb2。在这些样品中,Orb2以单体、低聚物或自聚集丝(即淀粉状蛋白)形式存在。这些研究人员首先证实Orb2自聚集丝能够促进更多的自聚集丝形成,并且这些纯化的Orb2形式具有生化活性:在单体状态下能够抑制蛋白翻译,而在低聚物和自聚集丝状态下能够激活蛋白翻译。
他们的艰苦努力获得了回报。通过使用低温电镜和纯度超过97%的样品,Hervas及其同事们能够在2.6埃的分辨率下解析出内源性果蝇Orb2的结构。他们发现内源性Orb2形成了大约75纳米长的三重对称淀粉样蛋白丝。他们证实Orb2在交叉β淀粉样蛋白结构中聚集,并发现它的原丝核心的发夹状折叠(由31个氨基酸组成)通过亲水性界面堆积。
这项研究还为一个非常重要的问题---淀粉样蛋白通常与记忆丧失相关,然而一种神经元蛋白的淀粉样蛋白形式如何可能有助于存储记忆?---提供了部分答案。在这篇论文中,这些研究人员得出结论:与病原性淀粉样蛋白的疏水核心不同,Orb2自聚集丝的亲水性核心提示着某些神经元淀粉样蛋白如何可能成为稳定但可调节的记忆底物。
Si说,“这一发现改变了我们对蛋白折叠和组装的思考方式。我们如今对生物学的看法是:你拥有一个基因,你可以制造一串氨基酸,而且一旦一个多肽被制造出来,它就被设定成一种构象,这是因为它具有特定的功能。如果它偏离了这条路径,系统就会移除它。但是这项研究提示着细胞有时可以使得相同的蛋白形成完全不同的构象。它是怎么做到的?它什么时候这样做呢?”
某些蛋白的构象柔韧性打开了一种可能性,即一种蛋白可能具有多种功能,这取决于构象状态:Si及其实验室成员将热衷于研究这一现象。
虽然果蝇的记忆测试具有参考价值,但是Hervas和他的同事们接下来期待确定这样的功能性淀粉样蛋白是否也存在于小鼠和人类的神经系统中,特别是因为人类的神经系统特别容易受到淀粉样蛋白相关疾病的影响。
Hervas解释说,在小鼠和人类中,有四种CPEB亚型,每一种亚型都有几种变体。“小鼠中的某些特定亚型对于记忆整合也很重要,它们的蛋白序列与相应的人类CPEB亚型几乎相同。”
“我们开始研究从人类颞叶内侧---一种保持长久记忆的大脑结构---中提取的CPEB蛋白。我们打算解析出这种蛋白的结构,然后可能使用小鼠模型在记忆与蛋白结构之间建立关联性。”
Si反映说,“随着生物变得更加复杂,大脑是进化和多样化最多的系统之一。但是,如果研究一下所涉及的蛋白数量,那么这实际上并没有发生很大变化。一种可能性是,更复杂的生物系统利用这种构象空间来创造更多的功能。与其构建新的蛋白,还不如通过呈现不同的形状来产生新的功能。”
研究发现总结
蛋白通常被认为呈现单一形状,而蛋白的形状决定它的功能。但是,某些蛋白在自组装时可以采用次级形状,即“淀粉样蛋白”形式。从历史上看,淀粉样蛋白被认为是无功能的,甚至是引起疾病的原因,特别是在大脑中,就像阿尔茨海默病中的那样。
不过,令人吃惊的是,Si博士等人的研究已表明长期记忆的形成和持久存在所必需的蛋白Orb2可能会呈现淀粉样蛋白的形状作为它的正常和必要功能的一部分。但是,在此之前,人们还没有确定Orb2是否以真正的淀粉样蛋白形式存在于大脑中,这是因为它的结构是未知的。
这些研究人员解析出从天然来源(数百万个果蝇的大脑)中纯化出的Orb2在原子分辨率下的结构,并证实它确实以功能性淀粉样蛋白的形式存在于大脑中。这项研究是首次从大脑中纯化和在结构上描述一种具有已知生物学功能的淀粉样蛋白。有趣的是,Orb2的淀粉样蛋白形式促进了记忆相关蛋白的产生,而Orb2的单体形式抑制记忆相关蛋白的产生,这表明一种蛋白可以通过呈现多种形状来发挥多种功能。
这些发现提出了两个有趣的可能性,将在Si实验室中进一步探讨:一种可能性就是这样的功能性神经元淀粉样蛋白是否也可能也存在于人类中;另一种可能性就是已知具有特定功能的其他蛋白是否可能呈现淀粉样蛋白形状以实现备用功能。(生物谷 Bioon.com)
参考资料:
1.Ruben Hervas et al. Cryo-EM structure of a neuronal functional amyloid implicated in memory persistence in Drosophila. Science, 2020, doi:10.1126/science.aba3526.
2.How the historically misunderstood amyloid helps to store memories
https://medicalxpress.com/news/2020-03-historically-misunderstood-amyloid-memories.html
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


