博士期间已Nature+Science在手,年仅30的她再发Science,揭示全新的蛋白质降解机制
来源:生物世界 2023-09-12 10:42
总的来说,这项研究发现的Midnolin-蛋白酶体途径,可能代表了蛋白酶体绕过传统的泛素化系统来实现许多核蛋白选择性降解的通用机制。
短寿命蛋白(Short-lived proteins)通过调控细胞中的基因表达来执行许多重要任务,从帮助大脑形成连接,到帮助身体建立免疫防御。这些蛋白质在细胞核中产生,尽管它们很重要,但当它们完成任务后,就会被迅速降解,而被发现40多年来,它们究竟是如何被降解的,却一直不清楚。
众所周知,细胞可以通过泛素化标记来降解蛋白质,泛素标签告诉蛋白酶体(Proteasome)这些被标记蛋白不再需要了,蛋白酶体随后就会破坏它们。2004年,三位科学家因发现这种泛素介导的蛋白质降解而获得了诺贝尔化学奖。
然而,有时候蛋白酶体在不依赖泛素标签的情况下降解蛋白质,这表明细胞中存在着另一种非泛素依赖性的蛋白质降解机制。
近日,哈佛大学医学院 Michael E. Greenberg 教授和 Stephen J. Elledge 教授团队(古欣、Christopher Nardone为共同第一作者)在 Science 期刊发表了题为:The midnolin-proteasome pathway catches proteins for ubiquitination-independent degradation 的研究论文。
该研究发现了一种Midnolin-蛋白酶体途径,这可能代表了蛋白酶体绕过经典的泛素化系统来实现细胞核蛋白选择性降解的通用机制,这些被降解的核蛋白通常对基因转录至关重要,与大脑、免疫系统和发育密切相关,这一蛋白降解新机制转化潜力巨大,有望通过调控蛋白质水平实现对多种疾病的治疗。

论文第一作者古欣博士表示,这些特定的短寿命蛋白质已经被发现40多年了,但一直不清楚它们究竟是如何被降解的。论文共同第一作者 Christopher Nardone 表示,这一新发现的蛋白降解机制非常简单,也非常优雅,这是一个基础科学发现,但对未来有很多影响。

古欣博士
古欣于2015年本科毕业于北京大学,此后前往麻省理工学院(MIT)读博,博士期间,她作为第一作者,分别在 Nature (2022年)和 Science (2017年)发表了研究论文。博士毕业后,古欣前往哈佛大学医学院 Michael Greenberg 教授实验室从事博士后研究,2022年初,她开始了这项寻找蛋白质降解新机制的研究。
刺激诱导转录因子,是在细胞刺激下产生的,它们会移动到细胞核启动其他基因,然后迅速被降解掉。在哺乳动物中,对生长因子、神经元和免疫刺激的转录反应是由一组被称为立早基因(Immediate early genes,IEG)的基因所介导的,IEG mRNA在初始刺激后几分钟内积累,一旦完成翻译后,其蛋白质会被迅速降解,从而出现短暂的蛋白质表达爆发。这些IEG蛋白极其不稳定,它们的半衰期非常短,一旦产生,就会迅速发挥功能,然后很快就会降解。但它们是如何被迅速靶向降解的,尚不清楚。
为了确定这些蛋白质在完成工作后被降解的机制,研究团队把目光聚焦在了两种团队熟悉的转录因子上——Fos和EGR1,这两种转录因子属于立早基因所表达的蛋白(IEG蛋白)。
研究团队通过全基因组CRISPR-Cas9筛选,在人类细胞系中寻找调控IEG蛋白稳定性的基因。筛选结果中最引人注目的是MIDN基因,在哺乳动物中,其编码一种没有被表征的Midnolin蛋白。
功能验证实验显示,在人类细胞系中敲除MIDN基因增加了EGR1和FosB的稳定性,而过表达MIDN基因则会降低了cFos、FosB和EGR的水平。进一步研究显示,除Fos和EGR1外,Midnolin蛋白可能还参与了细胞核内数百种其他转录因子的降解。
研究团队指出,通过功能获得性遗传筛选,该研究确定了一大批Midnolin蛋白的潜在靶点,这些靶点在核蛋白(尤其是转录调节因子)中高度富集,揭示了Midnolin蛋白的广泛功能是促进细胞核内蛋白质的降解,而Midnolin蛋白本身也主要位于细胞核内。
论文共同第一作者古欣和Christopher Nardone回忆道,当时他们对自己的研究结果感到震惊和怀疑,为了验证这些发现,他们需要弄清楚Midnolin蛋白具体是如何靶向和降解这么多不同的蛋白质的。
在AI预测蛋白质结构工具 AlphaFold 的帮助下,他们预测了Midnolin蛋白的结构,揭示了该蛋白由三个保守区域构成。他们将其中一个区域称为捕获域(Catch domain),该结构域可以有效“抓取”其他蛋白质,并将它们直接“送入”蛋白酶体进行降解。捕获域有效地捕获蛋白质的一个相对非结构化区域,使Midnolin蛋白能够捕获许多不同类型的蛋白质。
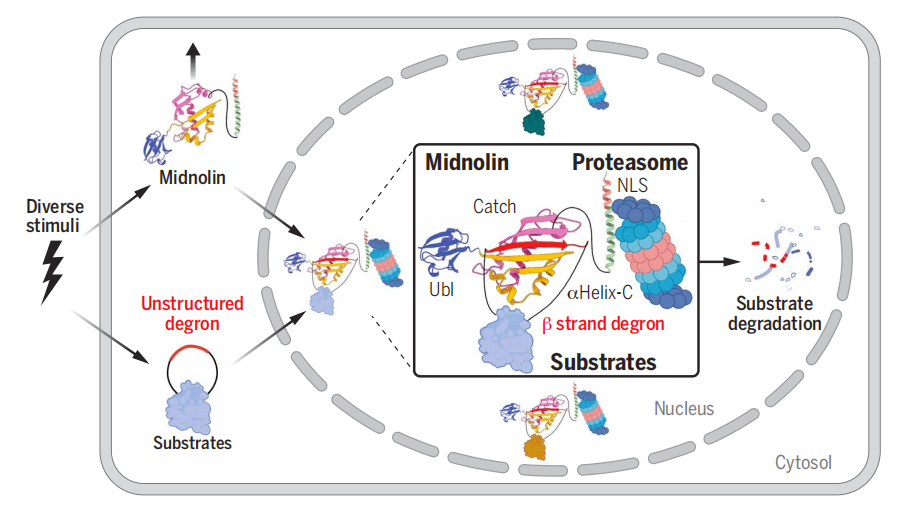
研究团队表示,Midnolin蛋白对靶蛋白的降解机制还没被完全揭示,还不清楚Midnolin蛋白在与蛋白酶体结合前是否已与靶蛋白相互作用,或者是否与蛋白酶体组成性结合,然后招募其底物,从而定义了细胞核内蛋白酶体的一个新的亚类。
接下来,研究团队的短期目标是更深入地研究这种新发现的Midnolin蛋白降解机制。他们正在进行更深入的结构研究,以更好地了解Midnolin蛋白捕获和降解蛋白质的细节。他们还构建了敲除Midnolin的小鼠模型,以进一步了解这种蛋白质在不同细胞和发育阶段中的作用。
值得一提的是,Midnolin的靶蛋白,例如Fos等IEG蛋白,与学习和记忆有关;而IRF4蛋白,在B细胞、T细胞和巨噬细胞的功能中发挥重要作用。因此,Midnolin蛋白降解机制具有诱人的转化潜力,可能提供了一种通过调控转录因子来调控基因表达的途径,从而用于治疗神经和精神疾病以及癌症。
古欣博士表示,团队目前正在积极探索的方向之一是如何实现这种蛋白降解机制的特异性,从而能够特异性降解感兴趣的蛋白质。
总的来说,这项研究发现的Midnolin-蛋白酶体途径,可能代表了蛋白酶体绕过传统的泛素化系统来实现许多核蛋白选择性降解的通用机制。
论文共同通讯作者 Stephen J. Elledge 教授表示,这项研究最令人兴奋的是,它让我们了解了一种新的通用的、非泛素化的蛋白质降解机制。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


