Nat Cell Biol:开发出CRISPR-HOT工具对特定基因和细胞进行荧光标记
来源:本站原创 2020-03-16 19:47
2020年3月16日讯/生物谷BIOON/---在一项新的研究中,来自荷兰胡布勒支研究所等研究机构的研究人员开发出一种新的遗传工具,用于标记人类类器官中的特定基因。他们使用这种称为CRISPR-HOT的遗传工具来研究肝细胞如何分裂和具有太多DNA的异常肝细胞如何出现。通过让癌基因TP53失去功能,他们发现异常肝细胞的非结构化分裂更为频繁,这可能有助于促进癌症
2020年3月16日讯/生物谷BIOON/---在一项新的研究中,来自荷兰胡布勒支研究所等研究机构的研究人员开发出一种新的遗传工具,用于标记人类类器官中的特定基因。他们使用这种称为CRISPR-HOT的遗传工具来研究肝细胞如何分裂和具有太多DNA的异常肝细胞如何出现。通过让癌基因TP53失去功能,他们发现异常肝细胞的非结构化分裂更为频繁,这可能有助于促进癌症产生。相关研究结果近期发表在Nature Cell Biology期刊上,论文标题为“Fast and efficient generation of knock-in human organoids using homology-independent CRISPR–Cas9 precision genome editing”。
类器官是可以在实验室中培养的微型器官。这些微型器官是从非常小的一块组织中生长出来的,这对各种器官来说都是可能的。通过遗传手段改变这些类器官的能力将极大地帮助研究生物学过程和疾病建模。然而,到目前为止,由于缺乏简单的基因组工程方法,人们已证实难以产生遗传改变的人类类器官。
CRISPR-HOT
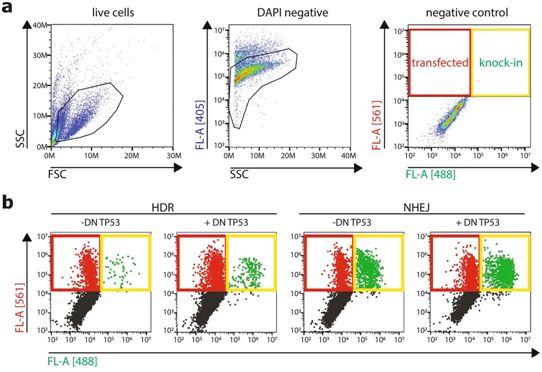
几年前,科学家们已发现,就像微小分子剪刀一样发挥作用的CRISPR/Cas9可以精确地切割DNA中的特定位置。这种新技术极大地帮助和简化了基因工程。论文共同第一作者、胡布勒支研究所的Delilah Hendriks说,“DNA中的较小切口可以激活细胞中的两种不同的修复机制,这两种机制可被人们用来迫使细胞在切口部位摄取新的DNA片段。”其中的一种修复机制称为非同源末端连接(non-homologous end joining),被认为经常犯错,因此直到现在仍不常用来插入新的DNA片段。论文共同第一作者、胡布勒支研究所的Benedetta Artegiani说,“鉴于早期的一些小鼠研究已表明可以通过非同源末端连接插入新的DNA片段,因此我们着手在人类类器官中测试这一点。”Artegiani和Hendriks随后发现通过非同源末端连接将任何DNA片段插入人类类器官,实际上比迄今为止使用的另一种称为同源介导修复(HDR)的修复机制更有效,更稳健。他们将这种新方法命名为CRISPR-HOT。
给细胞涂上不同的荧光颜色
这些研究人员随后使用CRISPR-HOT将荧光标记插入人类类器官的DNA中,从而使得这些荧光标记附着在他们想要研究的特定基因上。首先,他们标记了肠道中非常罕见的特定类型的细胞:肠内分泌细胞(enteroendocrine cell)。这些细胞产生激素来调节血糖水平、食物摄取和胃排空等功能。鉴于这些细胞非常稀有,因此很难研究它们。然而,通过使用CRISPR-HOT,他们可以轻松地将这些细胞“涂成”不同的颜色,然后轻松地对其进行识别和分析。其次,他们给源自肝脏中特定细胞类型---胆管细胞---的类器官涂上不同的颜色。他们使用CRISPR-HOT可视化观察了角蛋白(keratin),即参与细胞骨架的蛋白。鉴于他们可以以高分辨率查看这些角蛋白的详细信息,他们以超结构化的方式发现了它们的组装。当细胞发生特化或分化时,这些角蛋白也会改变表达。因此,他们预计,CRISPR-HOT可能能够用于研究细胞命运和分化。
肝脏中的异常细胞分裂
在肝脏内,有许多肝细胞含有比正常细胞多两倍(甚至更多倍)的DNA。目前尚不清楚这些细胞是如何形成的,以及它们是否能够分裂。老年人含有更多的这些异常肝细胞,但尚不清楚它们是否与癌症等疾病有关。 Artegiani和Hendriks使用CRISPR-HOT对肝细胞类器官中细胞分裂复合物的特定成分进行标记,并研究了细胞分裂的过程。Artegiani说,“我们观察到‘正常’的肝细胞非常有序地分裂,总是沿某个方向分裂为两个子细胞。”Hendriks说,“我们还发现在几次细胞分裂中,异常肝细胞形成了。我们第一次观察到‘正常’的肝细胞如何转变为异常肝细胞。”除此之外,他们还研究了肝癌中常见的TP53基因突变对肝细胞异常细胞分裂的影响。没有TP53,这些异常的肝细胞的分裂频率就会更高。这可能是TP53突变促进癌症产生的方式之一。
这些研究人员认为,CRISPR-HOT可应用于多种类型的人类类器官,可以可视化观察任何基因或细胞类型以及研究许多与发育和疾病相关的问题。(生物谷 Bioon.com)
参考资料:
1.Benedetta Artegiani et al. Fast and efficient generation of knock-in human organoids using homology-independent CRISPR–Cas9 precision genome editing. Nature Cell Biology, 2020, doi:10.1038/s41556-020-0472-5.
2.CRISPR-HOT: A new tool to 'color' specific genes and cells
https://phys.org/news/2020-03-crispr-hot-tool-specific-genes-cells.html

图片来自Nature Cell Biology, 2020, doi:10.1038/s41556-020-0472-5。
类器官是可以在实验室中培养的微型器官。这些微型器官是从非常小的一块组织中生长出来的,这对各种器官来说都是可能的。通过遗传手段改变这些类器官的能力将极大地帮助研究生物学过程和疾病建模。然而,到目前为止,由于缺乏简单的基因组工程方法,人们已证实难以产生遗传改变的人类类器官。
CRISPR-HOT
几年前,科学家们已发现,就像微小分子剪刀一样发挥作用的CRISPR/Cas9可以精确地切割DNA中的特定位置。这种新技术极大地帮助和简化了基因工程。论文共同第一作者、胡布勒支研究所的Delilah Hendriks说,“DNA中的较小切口可以激活细胞中的两种不同的修复机制,这两种机制可被人们用来迫使细胞在切口部位摄取新的DNA片段。”其中的一种修复机制称为非同源末端连接(non-homologous end joining),被认为经常犯错,因此直到现在仍不常用来插入新的DNA片段。论文共同第一作者、胡布勒支研究所的Benedetta Artegiani说,“鉴于早期的一些小鼠研究已表明可以通过非同源末端连接插入新的DNA片段,因此我们着手在人类类器官中测试这一点。”Artegiani和Hendriks随后发现通过非同源末端连接将任何DNA片段插入人类类器官,实际上比迄今为止使用的另一种称为同源介导修复(HDR)的修复机制更有效,更稳健。他们将这种新方法命名为CRISPR-HOT。
给细胞涂上不同的荧光颜色
这些研究人员随后使用CRISPR-HOT将荧光标记插入人类类器官的DNA中,从而使得这些荧光标记附着在他们想要研究的特定基因上。首先,他们标记了肠道中非常罕见的特定类型的细胞:肠内分泌细胞(enteroendocrine cell)。这些细胞产生激素来调节血糖水平、食物摄取和胃排空等功能。鉴于这些细胞非常稀有,因此很难研究它们。然而,通过使用CRISPR-HOT,他们可以轻松地将这些细胞“涂成”不同的颜色,然后轻松地对其进行识别和分析。其次,他们给源自肝脏中特定细胞类型---胆管细胞---的类器官涂上不同的颜色。他们使用CRISPR-HOT可视化观察了角蛋白(keratin),即参与细胞骨架的蛋白。鉴于他们可以以高分辨率查看这些角蛋白的详细信息,他们以超结构化的方式发现了它们的组装。当细胞发生特化或分化时,这些角蛋白也会改变表达。因此,他们预计,CRISPR-HOT可能能够用于研究细胞命运和分化。
肝脏中的异常细胞分裂
在肝脏内,有许多肝细胞含有比正常细胞多两倍(甚至更多倍)的DNA。目前尚不清楚这些细胞是如何形成的,以及它们是否能够分裂。老年人含有更多的这些异常肝细胞,但尚不清楚它们是否与癌症等疾病有关。 Artegiani和Hendriks使用CRISPR-HOT对肝细胞类器官中细胞分裂复合物的特定成分进行标记,并研究了细胞分裂的过程。Artegiani说,“我们观察到‘正常’的肝细胞非常有序地分裂,总是沿某个方向分裂为两个子细胞。”Hendriks说,“我们还发现在几次细胞分裂中,异常肝细胞形成了。我们第一次观察到‘正常’的肝细胞如何转变为异常肝细胞。”除此之外,他们还研究了肝癌中常见的TP53基因突变对肝细胞异常细胞分裂的影响。没有TP53,这些异常的肝细胞的分裂频率就会更高。这可能是TP53突变促进癌症产生的方式之一。
这些研究人员认为,CRISPR-HOT可应用于多种类型的人类类器官,可以可视化观察任何基因或细胞类型以及研究许多与发育和疾病相关的问题。(生物谷 Bioon.com)
参考资料:
1.Benedetta Artegiani et al. Fast and efficient generation of knock-in human organoids using homology-independent CRISPR–Cas9 precision genome editing. Nature Cell Biology, 2020, doi:10.1038/s41556-020-0472-5.
2.CRISPR-HOT: A new tool to 'color' specific genes and cells
https://phys.org/news/2020-03-crispr-hot-tool-specific-genes-cells.html
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


