人巨细胞病毒致神经损伤机制研究获进展
来源:武汉病毒所 2023-05-10 14:55
该研究揭示HCMV感染引起神经发育异常的新调控机制,即HCMV感染通过下调Cx43导致未成熟神经元迁移缺陷,进而影响胎脑发育。这为解析HCMV感染诱导先天性脑发育障碍提供了新证据。
中国科学院武汉病毒研究所罗敏华团队在《病毒学杂志》(Journal of Virology)上,在线发表了题为Human Cytomegalovirus IE1 impairs neuronal migration via downregulating connexin 43的研究论文。该研究揭示了人巨细胞病毒(human cytomegalovirus,HCMV)感染导致胎脑发育损伤的新机制。
先天性HCMV感染是导致出生缺陷的最重要感染性病因。严重的HCMV感染可导致胎儿脑组织出现无脑回、多个小脑回、小脑发育不全畸形和脑室扩大等脑损伤。这些结构异常通常与孕早期神经发生和神经元迁移异常有关。罗敏华团队近期建立的先天性鼠巨细胞病毒(MCMV)感染模型,显示感染鼠呈现脑皮层萎缩和神经元迁移异常,但具体分子机制尚未明确。
间隙连接蛋白43(connexin43,Cx43)在未成熟神经元迁移过程中具有重要作用。Cx43在脑皮层的水平下调会导致神经元迁移受损。本研究在HCMV感染的神经前体细胞(neural progenitor cells,NPCs)模型中发现病毒感染可通过泛素蛋白酶体途径下调Cx43蛋白水平。进一步的病毒蛋白筛选鉴定出立即早期蛋白IE1介导Cx43下调。对IE1和Cx43的相互作用分析发现,Cx43结合在IE1的氨基酸236-250区段,而缺失此结合位点IE1则丧失下调Cx43的能力。为了探讨IE1下调Cx43产生的生物学效应,研究通过胚胎电转实现了IE1在小鼠胚脑皮层的异源表达。体内结果证实了IE1下调胎脑的Cx43,发现了IE1表达明显抑制神经元迁移、导致皮层萎缩。通过异源补偿Cx43则可减轻IE1导致的神经迁移损伤,而IE1的Cx43结合位点缺失突变体丧失了在体内诱导神经损伤的能力,说明神经元迁移异常是IE1介导的Cx43下调所致。
该研究揭示HCMV感染引起神经发育异常的新调控机制,即HCMV感染通过下调Cx43导致未成熟神经元迁移缺陷,进而影响胎脑发育。这为解析HCMV感染诱导先天性脑发育障碍提供了新证据。该研究由武汉病毒所、北京脑科学与类脑研究中心和复旦大学附属上海市公共卫生临床中心合作完成。研究工作得到国家自然科学基金的支持。
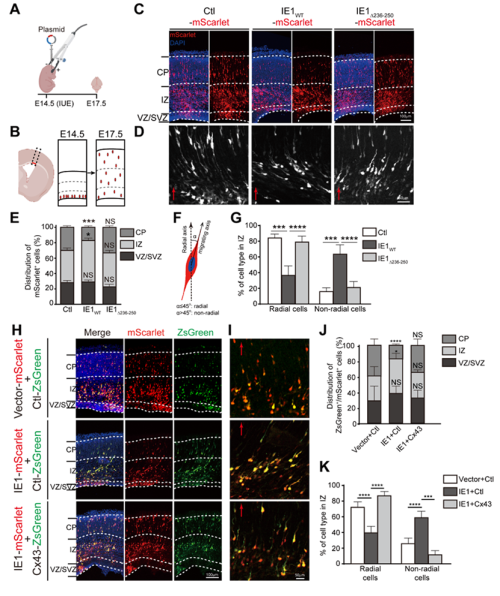
IE1通过下调Cx43影响神经元放射迁移过程
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


