Nature Medicine:胰腺癌的致命信号!KRAS突变剂量如何决定患者命运?
来源:生物探索 2025-01-08 15:44
随着KRAS靶向治疗的逐步成熟,结合基因组学和动态监测的综合治疗方案,有望从根本上改变PDAC患者的治疗前景。
胰腺癌(Pancreatic cancer)是全球癌症相关死亡的第三大原因,其五年生存率低至10%,是一种预后极差的恶性肿瘤。胰腺导管腺癌(Pancreatic ductal adenocarcinoma, PDAC)是胰腺癌最常见的组织学类型,占所有病例的绝大多数。研究发现,超过90%的PDAC患者存在KRAS基因的活化突变(KRAS mutations),这一突变不仅与肿瘤的形成和进展密切相关,也长期以来被认为是难以针对的“不可成药”(undruggable)靶点。
尽管近年来随着分子生物学技术的进步,针对KRAS突变的疗法在临床试验中取得了一定突破,但PDAC的整体治疗效果仍不理想。多数患者在确诊时已进入疾病晚期(如局部晚期或转移性阶段),无法手术切除,主要依赖化疗维持生存。然而,如何精准预测患者的预后,优化治疗方案,仍然是PDAC研究的关键挑战之一。
在这一背景下,1月3日Nature Medicine的研究报道“Clinicogenomic landscape of pancreatic adenocarcinoma identifies KRAS mutant dosage as prognostic of overall survival”,研究人员通过对2336名PDAC患者的临床和基因组数据进行全面分析,揭示了KRAS突变基因剂量(mutant allele dosage)与疾病进展及患者生存率之间的重要关联。研究发现,KRAS突变等位基因的剂量增益不仅是疾病进展的标志,也显著影响患者的整体生存期。此外,对于那些KRAS野生型(KRAS wild-type)患者,研究还发现了其他致癌途径的潜在作用,为临床治疗提供了新的思路。
这项研究不仅为PDAC的分子分型和预后评估提供了新的视角,也为开发更精准的靶向疗法奠定了基础。在未来,随着KRAS靶向疗法的进一步发展,这些发现或将改变胰腺癌的诊断和治疗格局,为患者带来新的希望。

胰腺癌的沉默杀手:现状与挑战
胰腺癌被称为“癌症之王”,其隐匿性和高致死率使其成为现代医学面临的巨大挑战之一。根据全球统计数据,胰腺癌已攀升为癌症相关死亡的第三大原因,其五年生存率仅约为10%。这种恶性肿瘤的发病率虽相对较低,但其预后极差,给患者及其家庭带来了沉重的心理和经济负担。
胰腺导管腺癌(PDAC)的主要特征
胰腺导管腺癌(Pancreatic ductal adenocarcinoma, PDAC)是胰腺癌中最常见的类型,占所有病例的绝大多数。研究发现,PDAC的分子特征高度复杂,其中超过90%的病例存在KRAS基因的突变。这种突变的发生率远远高于其他肿瘤类型,表明其在疾病发生和进展中的关键作用。此外,TP53、CDKN2A和SMAD4等基因的突变也常见于PDAC患者,为肿瘤的恶性特性提供了更深层的分子基础。
在临床上,PDAC的特征包括早期症状不明显、诊断时通常已属晚期、对治疗的耐药性强等。研究显示,在2336名患者中,有44%的病例在确诊时已发生远处转移,只有31%的患者具有可手术切除的肿瘤。这种晚期确诊率严重限制了治疗选择,也直接影响了患者的生存率。
诊断与治疗的难点
PDAC的高致死率不仅与其侵袭性生物学特性有关,还与目前诊断和治疗的局限性密切相关。由于胰腺位于腹腔深处,肿瘤在早期往往难以被察觉,患者出现明显症状时,往往已进入疾病的中晚期。此外,胰腺组织与重要血管和器官关系密切,手术难度高,切缘的微小肿瘤残留也可能导致术后复发。在临床数据中,仅约41%的患者接受了切除手术,而这些患者的生存期显著优于未能接受手术者。
在治疗方面,化疗仍然是PDAC患者的主要选择。然而,这种恶性肿瘤对化疗药物的敏感性有限,且患者个体间的疗效差异明显。研究指出,一些分子亚型(如BRCA1/2突变)患者对特定治疗可能更敏感,但总体上PDAC的治疗效果仍难以令人满意。近年来,尽管针对KRAS基因突变的靶向疗法在临床试验中初见曙光,但它们尚未在临床广泛应用。
KRAS基因突变:胰腺癌的分子开关
KRAS基因(Kirsten rat sarcoma viral oncogene homolog)作为一种原癌基因(proto-oncogene),在胰腺癌的发生和进展中扮演着至关重要的角色。它的突变不仅构成了胰腺导管腺癌(PDAC)的分子基础,也被视为探索该疾病机制和治疗策略的关键目标。
KRAS基因的基本功能及其在胰腺癌中的角色
KRAS基因编码一种小分子GTP酶(GTPase),在细胞信号传导中起核心作用。正常情况下,KRAS蛋白在结合GTP时被激活,驱动下游信号通路如RAS-RAF-MEK-ERK通路,从而调控细胞增殖、分化和存活。当GTP水解为GDP时,KRAS蛋白失活,信号传导停止。然而,KRAS基因的突变(尤其是第12号密码子的点突变)会导致KRAS蛋白持续处于活化状态,进而导致细胞的异常增殖,形成肿瘤。
研究表明,超过90%的PDAC患者携带KRAS基因的活化突变,这使其成为胰腺癌的主要驱动基因。这些突变不仅启动了肿瘤的形成,还赋予其更强的侵袭能力和耐药性,是PDAC预后差的重要原因之一。
KRAS突变的分布及其与肿瘤进展的关系
KRAS突变的频率在PDAC中极高,具体表现为不同亚型的分布和功能差异。数据表明,在PDAC患者中,最常见的KRAS突变位点集中在第12号密码子,包括G12D(41%)、G12V(32%)和G12R(16%)。这些突变具有不同的分子特性:例如,G12D突变更易激活RAS通路的转录程序。这些位点突变虽然位于同一基因上,但其生物学效应和临床预后可能有所差异。
此外,KRAS突变的剂量效应(mutant allele dosage)也对肿瘤的进展和患者的生存产生了显著影响。研究发现,约42%的KRAS突变肿瘤存在等位基因不平衡(allelic imbalance),即突变等位基因的数量高于野生型等位基因。这种剂量增益与疾病晚期表现密切相关,尤其是在发生基因组倍增(WGD, whole genome doubling)的患者中,这种不平衡的发生率高达75%。进一步分析显示,KRAS突变剂量增益的患者整体生存期显著缩短,无论疾病分期如何,这一趋势均一致。
KRAS野生型(KRAS wild-type)患者的特征
尽管KRAS突变在PDAC中高度普遍,但仍有约5%的患者未检测到KRAS突变,成为所谓的KRAS野生型(KRAS wild-type, KRASWT)患者。这一人群在分子和临床特征上呈现出显著差异。
KRASWT患者的肿瘤中,常见其他MAPK通路基因的致癌突变,例如BRAF、NTRK1和NTRK3。这些基因的改变为MAPK信号通路的激活提供了另一种机制,使KRASWT患者在分子水平上形成独特的亚型。此外,KRASWT患者的诊断年龄较早(中位数为58岁,相比KRAS突变患者的67岁),并且显示出更好的生存预后。这一发现强调了KRAS突变和疾病恶化之间的紧密联系,同时也表明KRASWT患者可能具有不同的致癌路径和治疗靶点。
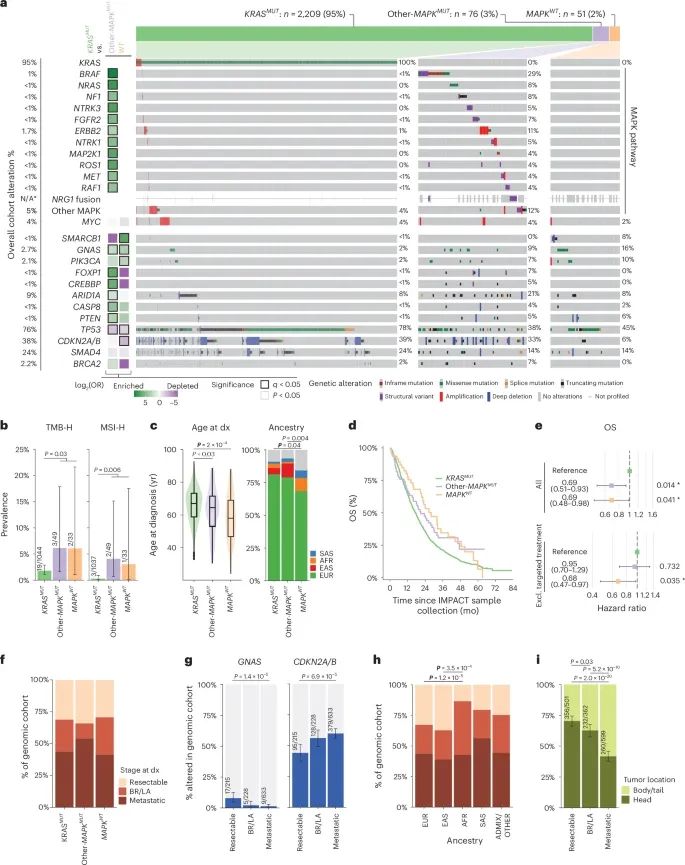
胰腺导管腺癌(PDAC)的体细胞改变(Credit: Nature Medicine)
a. 体细胞致癌基因突变的Oncoprint图
该部分显示了在KRAS突变型(KRASMUT)、其他-MAPK基因突变型(other-MAPKMUT)和MAPK野生型(MAPKWT)三大基因组亚型中,主要致癌基因的突变分布。左侧的Tile plot表明,相较于KRASMUT,其他-MAPKMUT和MAPKWT亚型中某些基因突变的显著富集情况。分析采用双侧Fisher精确检验评估统计显著性。例如,NRG1融合在其他-MAPKMUT亚型中几乎独占,而在KRASMUT亚型中极少见。此外,还分析了其他MAPK信号通路基因(如FGFR1、ERBB3、EGFR等)的突变情况。
b. TMB-H和MSI-H的分布
高肿瘤突变负荷(TMB-H)和微卫星不稳定性(MSI-H)的出现率根据基因组亚型进行了比较,数据基于纯度≥30%的样本(n=1,126)。结果显示,TMB-H和MSI-H在KRAS野生型亚型中更为常见,表明这一亚型可能具有独特的致癌机制。
c. 各亚型的诊断年龄
不同基因组亚型患者的诊断年龄通过箱线图表示(n=2,336)。统计分析显示,KRAS突变型患者的中位诊断年龄最高,而其他-MAPKMUT和MAPKWT患者则更早发病,尤其是MAPKWT患者,其诊断中位年龄仅为58岁。
d. 各亚型患者的总体生存(OS)
Kaplan-Meier曲线展示了三种亚型的总体生存(OS)。KRASMUT患者的生存期显著低于其他两个亚型,而MAPKWT患者表现出最佳生存期。这表明基因组亚型在预后中具有重要作用。
e. 多变量Cox回归模型的生存分析
森林图展示了三种基因组亚型在总体队列(n=2,270)以及未接受靶向治疗患者(n=2,187)中的生存风险比(HR)。模型根据诊断阶段分层,并调整了性别、年龄、遗传背景、疾病状态、手术切除情况及样本采集时间间隔等因素。结果进一步支持了MAPKWT和other-MAPKMUT亚型在生存期上的优势。
f. 不同亚型的诊断阶段分布
不同基因组亚型患者在诊断时的疾病分期(可切除、局部晚期、转移性)分布存在显著差异。KRASMUT患者更可能在晚期阶段确诊,而MAPKWT患者更倾向于较早期诊断。
g. GNAS和CDKN2A/CDKN2B突变的分期分布
在纯度超过30%的样本中(n=1,076),GNAS和CDKN2A/CDKN2B基因突变的分布随疾病分期变化显著。例如,GNAS突变更常见于可切除肿瘤,而CDKN2A/CDKN2B突变的频率则随疾病进展而增加。
h. 遗传背景与诊断阶段的关系
患者的遗传背景在不同诊断阶段的分布也被分析。数据显示,非洲裔患者在晚期阶段的比例显著高于其他族裔,而欧洲裔和东亚裔患者则更多在早期确诊。
i. 肿瘤部位与疾病分期的关联
肿瘤的发生部位(胰头或胰体/尾)与诊断阶段密切相关。胰头肿瘤更多见于可切除病例,而胰体/尾部肿瘤则与转移性疾病相关。
基因组学视角下的胰腺癌分型
随着基因组学技术的进步,研究人员逐渐揭示胰腺导管腺癌(PDAC)这一复杂肿瘤的分子基础。通过对KRAS基因及相关信号通路的深入研究,PDAC被分为三大基因组亚型:KRAS突变型(KRAS mutant, KRASMUT)、其他-MAPK基因突变型(other-MAPK mutant, other-MAPKMUT)和MAPK野生型(MAPK wild-type, MAPKWT)。这些亚型不仅反映了肿瘤的致癌机制,也揭示了患者生存预后的显著差异。
三大亚型的定义与分布
在基因组层面,PDAC的分型主要基于MAPK信号通路的突变状态:
KRAS突变型(KRASMUT):占PDAC病例的绝大多数(95%),以KRAS基因第12位密码子的点突变为主要特征,包括G12D、G12V和G12R等突变。这些突变通过持续激活RAS-ERK信号通路驱动肿瘤的形成和进展。
其他-MAPK基因突变型(other-MAPKMUT):约占3%,KRAS基因保持野生型(wild-type),但在BRAF、NTRK1、NTRK3等MAPK通路基因中存在致癌突变。这类肿瘤通过替代机制激活相同的信号通路。
MAPK野生型(MAPKWT):仅占2%,既无KRAS突变,也无其他MAPK通路基因的显著突变。这一亚型可能涉及非MAPK途径的肿瘤驱动机制,具体特征仍在进一步研究中。
各亚型的临床和分子特征
三大亚型的分子特征和临床表现存在显著差异:
KRASMUT亚型:分布于各个疾病阶段,但其突变剂量的增加与晚期病情高度相关。这一亚型常伴随TP53(78%)和CDKN2A/B(60%)等基因的高突变率,显示出更高的侵袭性和更差的预后。
other-MAPKMUT亚型:这一亚型的BRAF突变具有与KRAS突变类似的分子特性,但肿瘤组织中ARID1A(21%)等基因突变的富集程度更高。此外,患者的诊断年龄(中位数64岁)相较KRASMUT患者更低,表明可能存在更早期的致病因素。
MAPKWT亚型:患者的诊断年龄进一步降低(中位数58岁),且在东亚人群中比例略高(4.8%)。这一亚型中,GNAS和PIK3CA等非MAPK基因突变的频率较高,提示其致癌机制或许与其他通路相关。
不同分型患者的生存差异
PDAC患者的生存预后显著受分子亚型影响。在多变量Cox回归分析中,KRASMUT患者的生存期最短,而other-MAPKMUT和MAPKWT患者表现出更好的生存预后。在所有临床阶段中,MAPKWT患者的生存期显著高于KRASMUT患者(调整后风险比HR_adj = 0.69,P = 0.041)。特别是对于无靶向治疗的患者,KRASMUT和other-MAPKMUT亚型的生存期差异趋于消失,而MAPKWT患者的生存优势依然显著(HR_adj = 0.68,P = 0.035)。
基于KRAS突变及其相关通路的分型不仅揭示了PDAC的分子异质性,也为个性化治疗提供了重要线索。例如,KRASWT患者可能受益于针对BRAF或NTRK突变的靶向治疗,而KRASMUT患者的治疗应更加关注突变剂量的影响。
KRAS突变剂量:决定预后的新标志
胰腺导管腺癌(PDAC)的侵袭性和治疗挑战,使得研究人员不断探索新的分子标志,以更好地评估疾病进展和患者预后。在KRAS基因广泛突变的背景下,研究表明,KRAS突变剂量(mutant allele dosage)的变化是一种重要的预后指标,其与肿瘤的进展和患者的生存密切相关。
KRAS突变剂量指的是肿瘤中KRAS突变等位基因的数量比例。正常情况下,KRAS基因在细胞中以等位基因的形式存在,分别来自父母各一份。在KRAS突变型(KRASMUT)PDAC中,如果突变等位基因数量显著高于野生型(wild-type, WT)等位基因,就被称为突变剂量增益(mutant allele gain)。
这一剂量增益并非简单的基因突变结果,而是通过多种机制(如基因组倍增和等位基因不平衡)累积形成。KRAS突变剂量的升高往往伴随着肿瘤侵袭性的增强和对治疗的耐受性升高,使其成为疾病进展的重要驱动力。
KRAS突变剂量与疾病分期和预后的关联
研究对2336名PDAC患者的基因组数据分析显示,约42%的KRASMUT肿瘤存在KRAS突变剂量增益,且这一现象在疾病晚期更为常见。例如,KRAS突变剂量增益在可切除肿瘤患者中的发生率为8%,在局部晚期患者中升至14%,而在转移性患者中则高达29%。
进一步的多变量分析表明,KRAS突变剂量与患者的整体生存期(OS)显著相关。例如,在未发生基因组倍增(WGD, whole genome doubling)的患者中,突变剂量增益使得患者的生存风险增加70%(HR_adj = 1.7,P = 3.5 × 10⁻⁷)。具体而言,在可切除肿瘤患者中,KRAS突变剂量增益者的中位生存期为23个月,而无增益者则为32个月;在转移性患者中,这一差距更加显著(8.5个月对13个月)。这些数据表明,KRAS突变剂量的变化不仅是疾病分期的标志,更是预后差的核心指标。
KRAS基因剂量变化背后的分子机制
KRAS突变剂量的变化,通常源于肿瘤细胞对突变等位基因的选择性扩增。主要机制包括:
基因组倍增(WGD):WGD是一种常见于晚期癌症的基因组事件,会导致染色体数量加倍。在WGD的肿瘤中,KRAS突变剂量增益的发生率从非WGD肿瘤的30%飙升至75%,并导致更严重的预后。
等位基因不平衡(allelic imbalance):包括KRAS突变等位基因的扩增或野生型等位基因的丢失。值得注意的是,研究发现,KRAS突变剂量的增益与野生型等位基因的丢失呈协同效应,进一步加剧了疾病的恶性特性。
突变特异性效应:不同类型的KRAS突变(如G12D、G12V等)在剂量增益下可能具有不同的功能效应,例如更高的信号通路激活强度或转移潜能。
靶向KRAS的希望:未来治疗的突破口
KRAS基因突变在胰腺导管腺癌(PDAC)中的高频出现,使其成为研究人员梦寐以求的靶点。然而,这一领域长期以来被视为“不可成药”(undruggable)的难题。随着新技术和新思路的涌现,靶向KRAS的治疗正逐渐成为攻克PDAC的重要突破口。
KRAS突变的传统治疗困境
KRAS基因突变导致的持续活化,使得其下游的RAS-ERK信号通路异常强大,驱动肿瘤细胞的无限增殖和对治疗的耐药性。然而,KRAS蛋白的独特结构,缺乏可靶向的口袋和结合位点,长期阻碍了药物的开发。此外,KRAS的功能复杂,与多个信号通路的交叉作用也增加了靶向治疗的挑战。
化疗是目前PDAC患者的主要治疗选择,但其效果有限。即便是采用一线方案如FOLFIRINOX或吉西他滨(Gemcitabine)联合治疗,患者的中位生存期仍然较短。针对KRAS的直接靶向药物开发困难,使得研究人员曾转而尝试干预其下游通路,如MEK或ERK抑制剂。然而,这些尝试由于缺乏疗效或副作用过大而未能广泛应用。
新兴的KRAS靶向疗法及其潜力
近年来,在KRAS靶向治疗领域取得了突破。KRAS G12C抑制剂的出现,为靶向特定KRAS突变提供了全新的思路。这些药物能够特异性结合KRAS G12C突变蛋白的活性位点,抑制其功能。目前,KRAS G12C抑制剂在非小细胞肺癌中的临床试验中已取得显著成果,PDAC患者的初步数据同样令人鼓舞。
此外,一些多功能靶向药物也正在研发中。例如,特异性RAS抑制剂(RAS inhibitors)和诱导突变KRAS降解的分子(PROTACs)显示出潜力。另一种前景广阔的方法是联合治疗,例如KRAS抑制剂与免疫检查点抑制剂或DNA修复靶向药物的联合应用,以增强治疗效果。
研究还发现,KRAS野生型(KRASWT)PDAC患者因其肿瘤中可能存在其他可靶向突变(如BRAF、NTRK)的特点,可能从特定的靶向治疗中获益。这一发现进一步拓宽了治疗的适应范围,为患者提供了新的希望。
结合KRAS剂量信息优化治疗的可能性
KRAS突变剂量的发现为个性化治疗带来了更多可能性。研究表明,KRAS突变剂量增益与疾病的侵袭性和治疗耐药性密切相关。将KRAS剂量信息纳入治疗决策,可能帮助临床医生更精准地为患者选择治疗方案。
例如,对于突变剂量较低的患者,标准化疗可能足以控制病情,而高剂量突变的患者则需要更激进的治疗策略,如KRAS靶向药物或联合疗法。进一步,基于液体活检的动态监测,可以实时评估KRAS剂量变化,为调整治疗方案提供依据。
随着KRAS靶向治疗的逐步成熟,结合基因组学和动态监测的综合治疗方案,有望从根本上改变PDAC患者的治疗前景。KRAS,曾经是治疗的障碍,如今正在成为攻克这一致命疾病的关键钥匙。这一领域的快速发展,不仅为患者带来更多生存希望,也为精准医疗的未来树立了新标杆。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


