《神经病学年鉴》:科学家首次发现,阿尔茨海默病患者的小胶质细胞存在铁死亡现象
来源:奇点糕 2023-09-19 14:31
俄勒冈健康与科学大学的研究团队对死亡的AD和血管性痴呆患者脑组织进行了分析,他们发现,患者大脑白质中的小胶质细胞存在退行性病变,它们吞噬受损的髓鞘碎片后,反被富含铁的髓鞘碎片所破坏,发生铁死亡。
在大脑衰老过程中,反复的大脑白质损伤会破坏白质完整性和髓鞘形成。白质损伤是阿尔茨海默病(AD)以及血管性认知障碍和痴呆的核心特征,通常导致进行性的认知功能下降[1-3]。
小胶质细胞在痴呆的进展中发挥重要作用,灰质相关激活的小胶质细胞高表达AD风险基因,吞噬退化的神经元,并导致AD相关早期突触丢失[4,5]。目前,小胶质细胞在白质损伤进展和相关认知下降中的潜在作用还不清楚。
为了搞清楚这个问题,俄勒冈健康与科学大学的研究团队对死亡的AD和血管性痴呆患者脑组织进行了分析,他们发现,患者大脑白质中的小胶质细胞存在退行性病变,它们吞噬受损的髓鞘碎片后,反被富含铁的髓鞘碎片所破坏,发生铁死亡。研究结果发表在《神经病学年鉴》杂志上[6]。
这是首次发现AD和血管性痴呆中小胶质细胞的铁死亡形式,也意味着,铁死亡可能是AD和血管性痴呆中白质损伤的主要机制,白质中的退行性小胶质细胞可作为一个新的治疗靶点。

髓鞘是包裹在神经元轴突外的一层“绝缘保护膜”,由髓磷脂构成,保护神经电信号的传导,髓鞘包裹轴突的损伤是衰老相关白质损伤的中枢神经病理学特征,髓鞘受损后,小胶质细胞会遵守本职工作,前来清除受损的髓鞘。
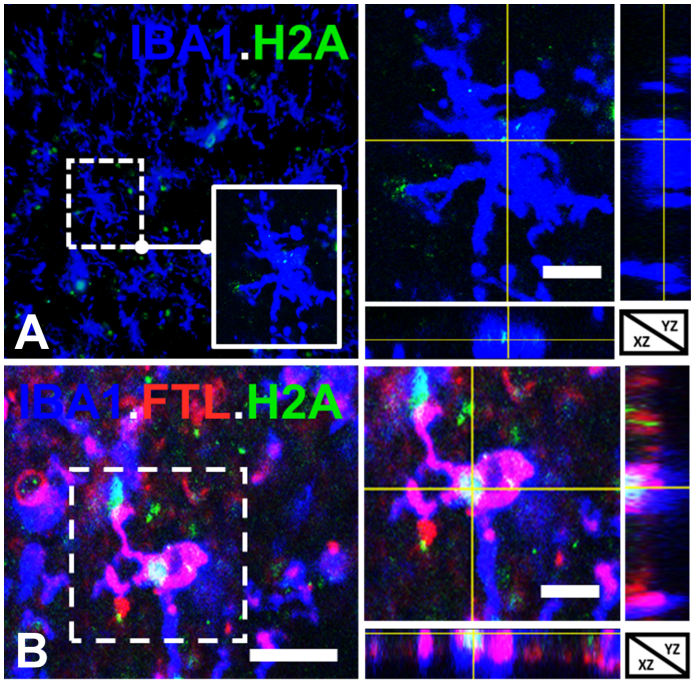
因此,研究人员扫描了受损白质中的小胶质细胞,出乎意料的,除了反应性小胶质细胞外,白质中还有大量符合退行性小胶质细胞(DM)特征的小胶质细胞,其中富集髓鞘碎片的DM占总DM的比例高达80-85%,并且髓鞘碎片的积累与小胶质细胞的退行性表型高度相关。
相比反应性小胶质细胞和其他分支,DM是受损白质中主要的小胶质细胞群,与微血管损伤相关白质损伤显著相关,这些DM以铁结合蛋白——轻链铁蛋白(FTL)为标志物,表现出由轻到重不等的退行性特征,受损白质中小胶质细胞功能障碍的进展与FTL结合的铁积累相一致。

研究的通讯作者Stephen Back教授(左)和第一作者Philip Adeniyi博士(右)
脂质代谢是小胶质细胞吞噬作用的重要组成部分,研究发现,衰老的人类大脑中有一部分由于脂滴积累而表现出促炎表型的小胶质细胞,吞噬作用存在缺陷,产生过量的活性氧,而这一次,研究人员发现,受损白质中的DM积累了大量髓鞘碎片,那么它们可能也存在脂质代谢障碍和过量的脂滴积累。
通过实验,研究人员确认,DM中确实存在这一现象,而非退行性小胶质细胞则没有,脂滴积累使得DM表现出脂质过氧化损伤和线粒体氧化应激。
脂质过氧化损伤的主要后果之一是产生活性醛与DNA反应形成的DNA加合物(DNA片段与致癌化学物质结合形成的复合物),因此,研究人员检测了DM的DNA损伤,发现根据退行性进展程度的不同,DM表现出与进展相一致的DNA双链断裂。
轻微变性(A)和退行性晚期(B)的小胶质细胞的DNA双链断裂情况
铁介导的脂质过氧化损伤是铁死亡的中心特征,研究人员检测了参与者受损白质中DM的富集是否伴随铁死亡标志物的增加。7个标志物中,有5个(GCLC、HMOX1、TFRC、IREB2和SLC1A5)在整个队列中表达增加。
基于这一初步发现,研究人员又对艾伦脑科学研究所的公开的RNA测序数据集进行了分析,这一数据集包含110例AD神经病理学改变和血管性脑损伤患者。差异性表达基因分析显示出一组独特的铁死亡基因在白质中富集并且表达明显增加,涉及调节脂质代谢、铁运输/代谢,以及谷氨酰胺和半胱氨酸的摄取用于谷胱甘肽合成。

研究人员表示,尽管大家都知道AD等痴呆症患者大脑中的小胶质细胞被激活,促进炎症,但在此之前,没有人注意到它们以铁死亡的形式大量死亡。目前,退行性小胶质细胞是AD和血管性痴呆相关认知功能下降的潜力治疗靶点之一,未来,他们的研究也可用于开发靶向减少小胶质细胞变性的药物,以治疗AD和血管性痴呆。
参考文献:
[1] Lee S, Viqar F, Zimmerman M E, et al. White matter hyperintensities are a core feature of Alzheimer's disease: evidence from the dominantly inherited Alzheimer network[J]. Annals of neurology, 2016, 79(6): 929-939.
[2] Iadecola C. The pathobiology of vascular dementia[J]. Neuron, 2013, 80(4): 844-866.
[3] Corriveau R A, Bosetti F, Emr M, et al. The science of vascular contributions to cognitive impairment and dementia (VCID): a framework for advancing research priorities in the cerebrovascular biology of cognitive decline[J]. Cellular and molecular neurobiology, 2016, 36: 281-288.
[4] Wendimu M Y, Hooks S B. Microglia phenotypes in aging and neurodegenerative diseases[J]. Cells, 2022, 11(13): 2091.
[5] Hong S, Beja-Glasser V F, Nfonoyim B M, et al. Complement and microglia mediate early synapse loss in Alzheimer mouse models[J]. Science, 2016, 352(6286): 712-716.
[6] Adeniyi P A, Gong X, MacGregor E, et al. Ferroptosis of microglia in aging human white matter injury[J]. Annals of Neurology, 2023.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


