《自然》:科学家在肿瘤中发现超级免疫抑制细胞
来源:奇点糕 2022-07-05 09:27
肿瘤免疫治疗为很多患者带来新的希望,但是免疫治疗仍面临很多困境,其中之一就是免疫治疗的靶点以及对应的信号通路同时存在于正常组织以及肿瘤中,缺乏严格的肿瘤特异性 [1,2]。
肿瘤免疫治疗为很多患者带来新的希望,但是免疫治疗仍面临很多困境,其中之一就是免疫治疗的靶点以及对应的信号通路同时存在于正常组织以及肿瘤中,缺乏严格的肿瘤特异性 [1,2]。
免疫浸润丰富的肿瘤存在一定程度的炎症,这是它们的一个特征,但是目前还不清楚肿瘤中的炎症与非癌组织炎症有什么不同,尤其是其中浸润的免疫细胞是否存在区别,以及这种区别能否用于开发新的肿瘤免疫治疗策略。
近日,由Fred Hutchinson癌症研究中心Martin Prlic教授领衔的研究团队在《自然》期刊发表研究成果[3],他们通过分析非癌的炎症组织与肿瘤的单细胞测序数据,发现相比于非癌的炎症组织,肿瘤中存在ICOS+IL1R1+Treg,并且这些Treg细胞具有极强的免疫抑制能力。
这项研究成果首次揭示了人体同一组织部位在非癌炎症状态与发生肿瘤时浸润免疫细胞的区别,并发现在肿瘤中特异性富集的Treg细胞,为后续开发针对性的肿瘤免疫治疗方法提供了依据。

论文首页截图
为了探究同一个组织器官在非癌炎症以及发生肿瘤的情况下免疫浸润有怎样的区别,Prlic教授团队收集了未经抗炎治疗的非癌炎症口腔黏膜(OM)组织以及头颈鳞状细胞癌(HNSCC)样本,并通过多色流式以及单细胞转录组测序的方式分析其中的免疫细胞种类与比例。
他们发现两种组织样本中浸润的免疫细胞种类基本相同,但是在HNSCC中有更多的CD25+CD127-Treg,单细胞转录组测序数据分析结果也显示CD25+ICOS+Treg在HNSCC中富集。

相比于OM,HNSCC中存在更多的CD25+CD127-Treg
为了更好地寻找到OM以及HNSCC中存在的不同的免疫细胞群体,研究团队从患者外周血、OM以及HNSCC样本中分离了CD3+细胞和Lin-HLA-DR+细胞进行单细胞转录组测序。通过对测序数据的抗原提呈细胞(APC)群体进行分析,研究团队发现相比于OM组织,HNSCC中有一些HLA-DR+的肥大细胞,并且HNSCC中的cDC1细胞明显减少。
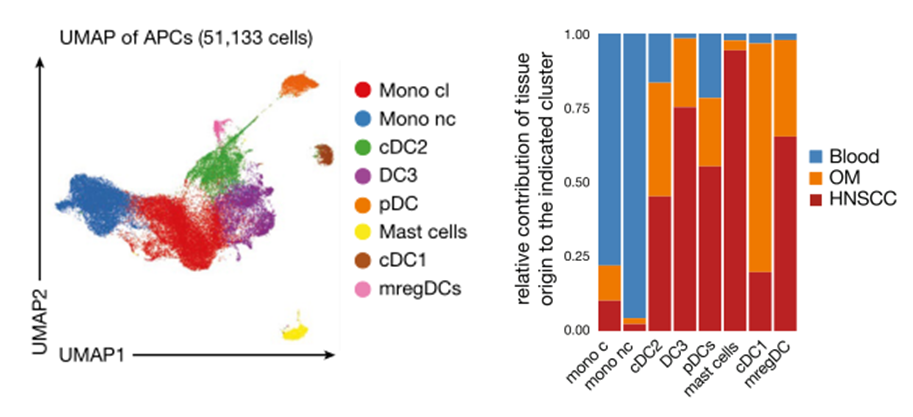
对浸润免疫细胞组成分析发现HNSCC中存在HLA-DR+肥大细胞,而cDC1显著减少
为了理解上述发现的潜在意义,研究团队分析了OM组织以及HNSCC中的APC-T相互作用。他们发现,在HNSCC中存在一群独特的IL1R1+Treg,而在患者的OM组织以及外周血中则没有发现同样的细胞群体。并且几乎所有IL1R1+Treg细胞均共表达ICOS以及IL18R1,同时有更高水平的趋化因子受体CXCR6的表达。与IL1R1-Treg相比,IL1R1+Treg的Foxp3表达水平没有显著差异,但是CTLA-4的表达水平更高。
那么肿瘤微环境中是否有IL1R1的配体呢?对冷冻的肿瘤组织样本进行分析发现,肿瘤组织中存在大量的IL-1α、IL-1β以及IL-18,这些数据表明,肿瘤内IL-1可能会作用于IL1R1+Treg细胞,但同时也使得我们好奇IL1R1+Treg的生物学功能与疾病之间是否存在一定的相关性。
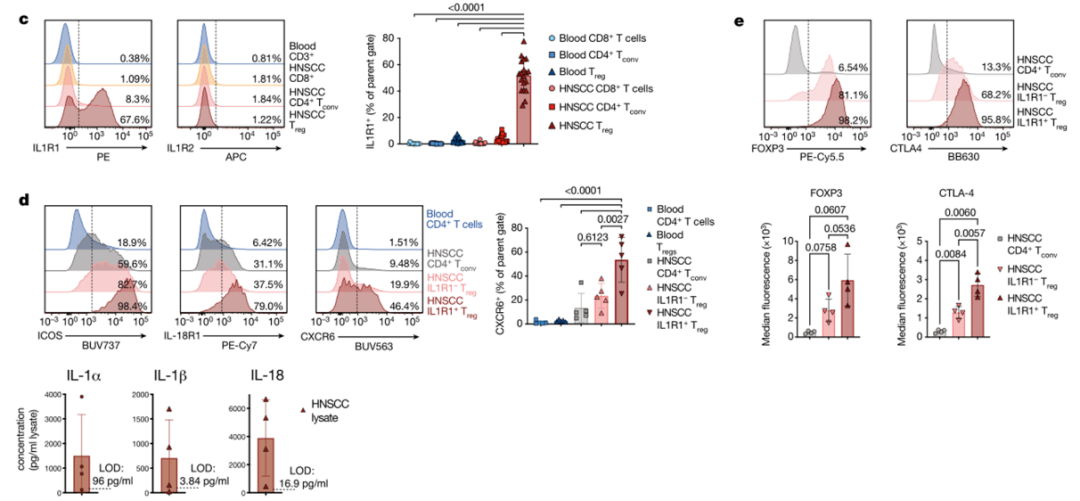
在HNSCC微环境中发现特殊的ILR1+Treg,表达更高水平的CXCR6、CTLA-4等,而肿瘤微环境中存在较多的IL-1,可能与之相互作用
为了探究IL1R1+Treg的抑制功能与IL1R1-Treg是否存在区别,研究团队分离了肿瘤中的IL1R1+Treg与IL1R1-Treg细胞,在体外比较了它们抑制肿瘤或者外周血来源的CD8+T细胞增殖的能力。结果显示,相比于IL1R1-Treg,IL1R1+Treg能够更强烈地抑制CD8+T细胞的增殖,并降低培养上清中细胞因子的浓度。这些数据表明IL1R1+Treg具有更强的免疫抑制功能。
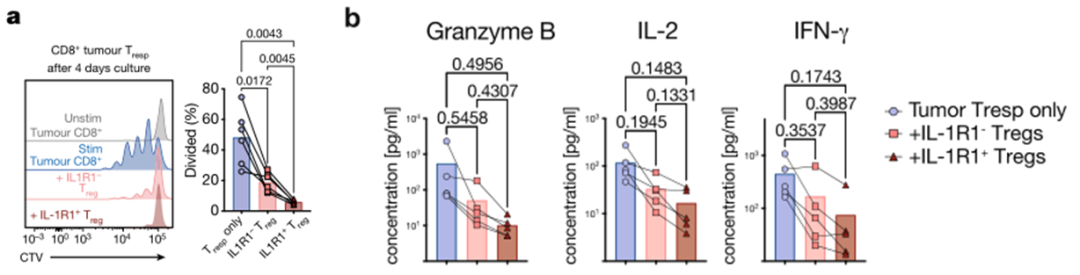
相比于ILR1-Treg,IL1R1+Treg抑制T增殖与细胞因子分泌的能力更强
细胞间相互作用分析发现IL1R1+Treg经历明显的TCR信号刺激,研究团队想知道TCR信号是否会影响IL1R1的表达。因此,他们分离了外周血中的Treg和HNSCC中IL1R1-Treg,分别使用anti-CD3/CD28/CD2刺激并检测其IL1R1表达变化。结果显示TCR信号刺激之后,Treg细胞表面IL1R1水平上调,表明TCR信号能够诱导Treg表达IL1R1。
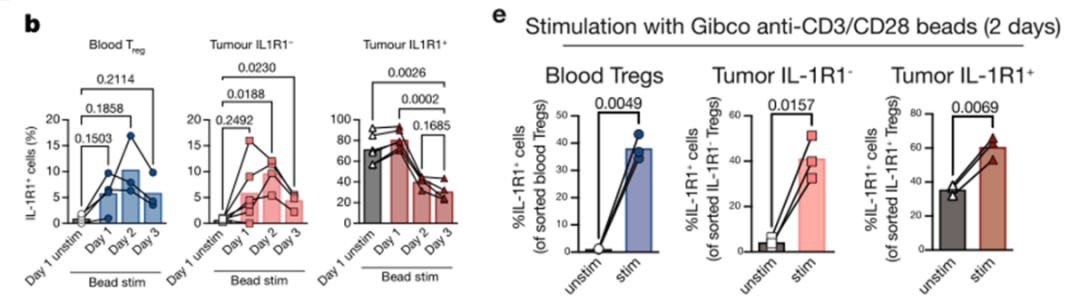
TCR信号刺激可以诱导Treg上调表达IL1R1
既然这些Treg细胞表达IL1R1,那么IL-1会不会对这群IL1R1+Treg产生表型或功能上的影响呢?通过对anti-CD3/CD28/CD2+IL-1诱导的Treg进行转录组测序分析,研究团队发现IL-1刺激后的Treg转录活跃程度明显增加,包括CD25在内的多种基因表达明显上调,但是Foxp3、Helios等表达并未变化,说明Treg的谱系稳定性依旧良好。不过IL-1刺激对肿瘤内的IL1R1+Treg的基因表达模式没有明显影响,这提示肿瘤浸润的Treg已经接受足够的信号刺激,处于活跃状态。
接下来研究团队对肿瘤浸润的IL1R1+Treg进行了TCR测序以分析其多样性。数据分析结果表明这些Treg经历明显的克隆扩增,10-20%的IL1R1+Treg细胞是克隆性扩增的,最大的10个克隆占患者总ILR1+Treg细胞数的5%以上,这代表这群IL1R1+Treg在肿瘤中处于高度活化并发挥功能的状态。
如果能够通过简单的标志物组合准确地找到这群IL1R1+Treg,可能会对临床上评估患者免疫状态有较大的帮助。研究团队结合测序数据与流式实验数据寻找这群IL1R1+Treg细胞的表面标志物,发现CD45+ICOS+IL1R1+细胞群几乎全部为IL1R1+Treg,因此使用这三个标志物可在造血系细胞中准确找到这群抑制功能较强的Treg。
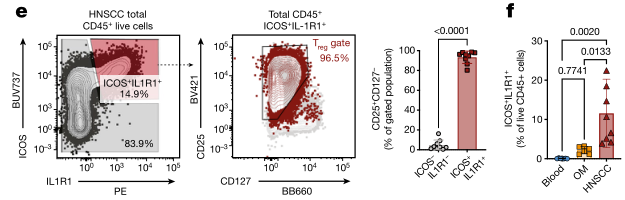
通过CD45、IL1R1、ICOS可以准确定位ILR1+Treg
那么IL1R1+Treg是HNSCC所独有的吗?研究团队检测了不同实体瘤样品,并分析了多个公开的单细胞转录组测序数据集,发现在多种实体瘤中均存在IL1R1+Treg,这可能揭示了一种普遍存在的抑制抗肿瘤免疫应答的机制。
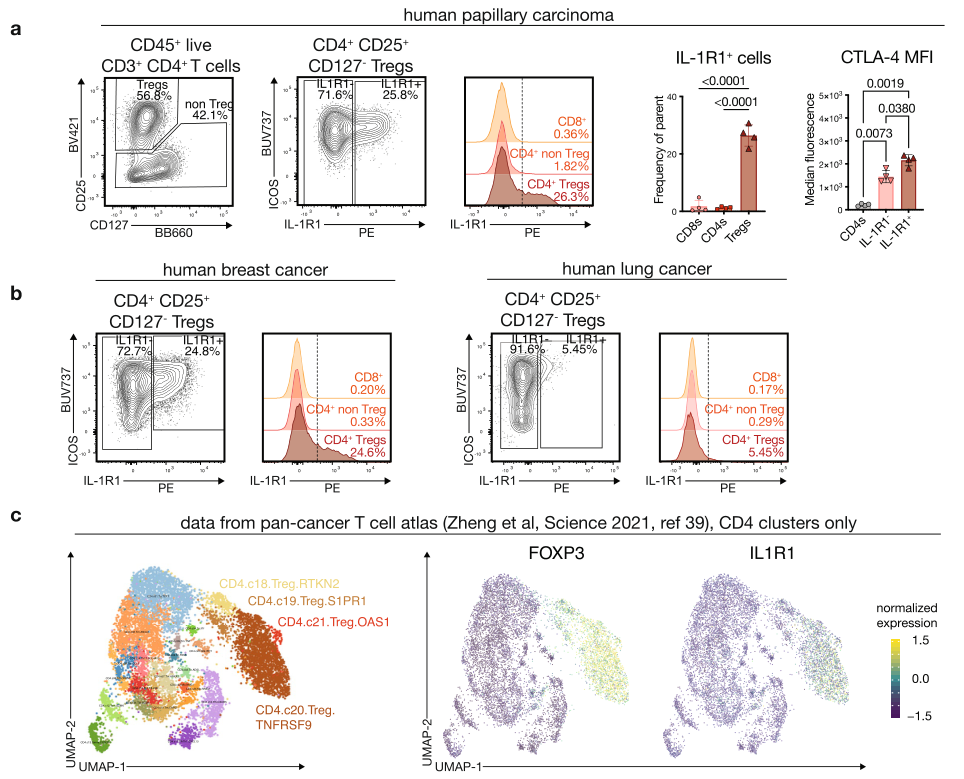
IL1R1+Treg存在于多种实体瘤中
总的来说,这项研究通过比较非癌炎症组织以及肿瘤组织浸润免疫细胞的差异找到了在肿瘤中特异性存在的IL1R1+Treg,而这群特殊的Treg拥有更为强大的免疫抑制功能,并存在于多种实体瘤中,可能代表一种广泛存在的肿瘤免疫抑制机制。这项研究成果也为后续开发针对性的肿瘤免疫治疗策略提供了靶点。
参考文献:
1. Greten FR, Grivennikov SI. Inflammation and Cancer: Triggers, Mechanisms, and Consequences. Immunity. 2019;51(1):27-41. doi:10.1016/j.immuni.2019.06.025
2. Mujal AM, Krummel MF. Immunity as a continuum of archetypes. Science. 2019;364(6435):28-29. doi:10.1126/science.aau8694
3. Mair F, Erickson JR, Frutoso M, et al. Extricating human tumour immune alterations from tissue inflammation [published online ahead of print, 2022 May 11]. Nature. 2022;10.1038/s41586-022-04718-w. doi:10.1038/s41586-022-04718-w
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


