NCB:黄韵/周育斌团队揭示TET2选择性调控DNA去甲基化与基因转录的关键机制
来源:网络 2024-09-12 09:24
该研究的结果提示破坏TET2凝聚体的形成可以成为血液癌症治疗的新靶点,为相关临床研究提供了新思路和方法。
来自德州农工大学的黄韵教授课题组,李佳教授课题组和周育斌教授课题组合作在Nature Cell Biology杂志上发表了最新研究 Perturbing TET2 condensation promotes aberrant genome-wide DNA methylation and curtails leukemia cell growth。德州农工大学的郭磊助理教授和洪婷婷博士为论文共同的第一作者。该论文深入探讨了甲基胞嘧啶双加氧酶TET2在精准调控DNA去甲基化和基因转录过程中的关键机制,并根据TET2独特的生化特性提供了潜在的临床治疗策略。

在这项研究中,该课题组揭示了TET2的一种先前未被认识到的液态凝聚 (liquid condensation) 特性,这种物理性质介导其特异性的识别基因组增强子区域,并维持其DNA羟甲基化和去甲基化的稳态。该课题组研究人员通过结构生物学分析,在TET2催化域内鉴定了一个低复杂度插入区(low complexity insert, LCI),这段无序的蛋白序列使驱使TET2形成大生物分子凝聚体。值得注意的是,LCI还可以进一步促进TET2与UTX和MLL4等表观遗传调节因子的共凝聚(co-condensation),从而确保其在的染色质特定区域的牢固结合。
针对LCI的氨基酸序列的一系列突变研究表明,LCI具有朊状结构域(PLDs),芳香残基的存在和排列方式决定了TET2的液态凝聚行为。有趣的是,新一代测序及多组学分析表明,破坏TET2的凝聚形成对其催化功能的影响很小,但极大影响了5hmC在基因组产生位置的准确性,最终导致全基因组范围内不受控制的DNA去甲基化。先前的大多数研究成果表明凝聚的物理化学性质丧失通常等同于蛋白质功能的失效,而该研究的数据揭示了在TET2凝聚体丧失的同时DNA去甲基化效率增强,为凝聚体介导的蛋白功能研究提供了不同的视角和新思路。
在人类白血病细胞和基因改造的白血病小鼠模型中,通过分子生物学或化学生物学的方法干扰TET2凝聚体的形成会导致TET2在基因组的结合位置发生改变,引发不受控制的DNA去甲基化和基因表达,从而有效抑制了白血病细胞的增殖和病情的进展。这种杀伤性似乎只存在于快速扩增的癌细胞里,却对正常细胞的生存无显著影响。该研究的结果提示破坏TET2凝聚体的形成可以成为血液癌症治疗的新靶点,为相关临床研究提供了新思路和方法。
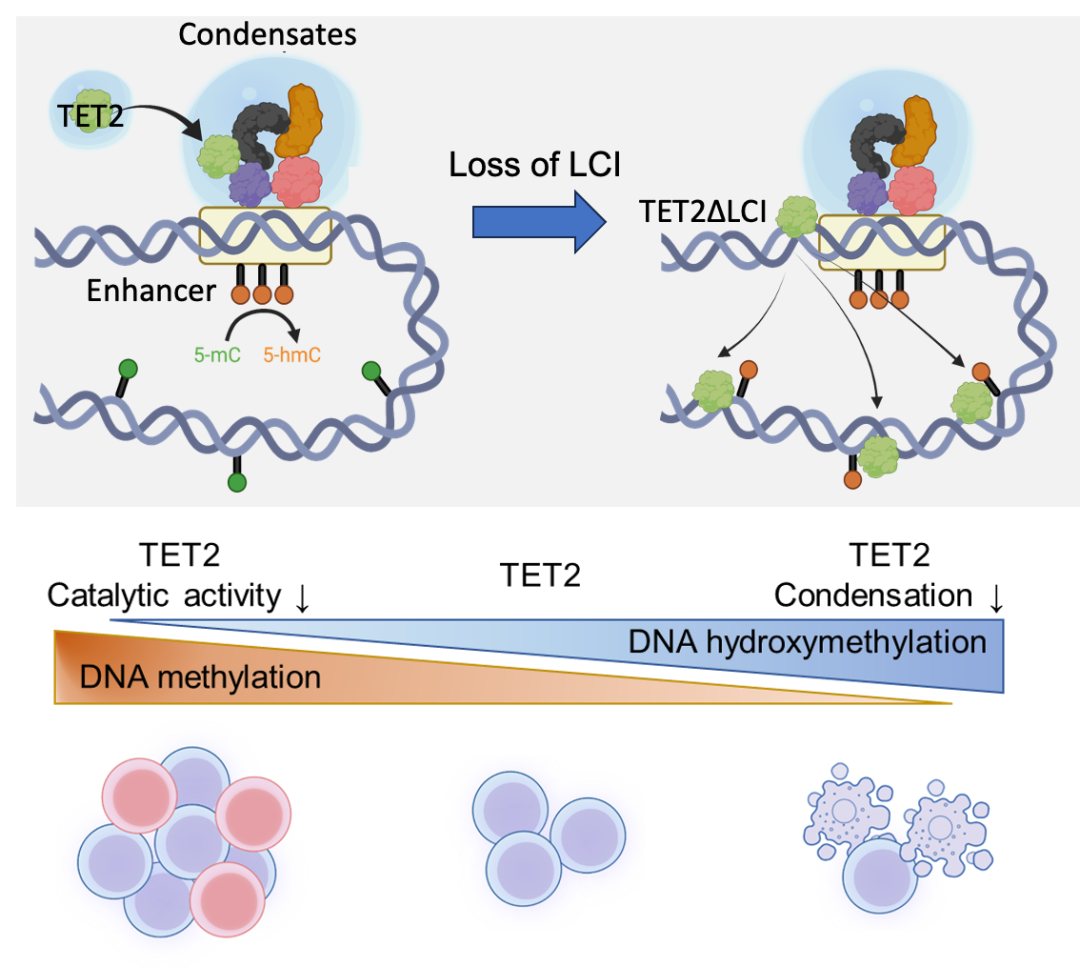
模式图:TET2通过LCI结构域形成液态凝聚体,并和增强子相关蛋白(UTX,MLL4)形成共凝聚体,从而确保其精确的基因组定位(如增强子区域)和特定位置的选择性DNA去甲基化。缺失或破坏LCI结构域的完整性导致TET2无法有效形成液态凝聚体,进而失去准确的基因组定位,从而引发全基因组不受控制的去甲基化,引发癌细胞的死亡。(Credit: Nature Cell Biology)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


