Advanced Science :四川大学杨莉团队制备新的递送系统,增强癌症疫苗免疫效力
来源:生物探索 2023-05-17 18:10
因此,该研究设计了LN靶向性增强的树状大分子KK2DP7聚合物纳米疫苗系统。
四川大学杨莉团队在Advanced Science在线发表题为“A Dendrimer Peptide (KK2DP7) Delivery System with Dual Functions of Lymph Node Targeting and Immune Adjuvants as a General Strategy for Cancer Immunotherapy”的研究论文,该研究报告了一种简单的树枝状大分子多肽(KK2DP7)纳米颗粒对基于OVA/新抗原的疫苗免疫效力的增强。
由于KK2DP7作为递送载体、免疫佐剂且促进树突细胞迁移的多种功能,其有效增加了抗原呈递细胞(APCs)的抗原摄取和交叉呈递效率,并通过APCs将抗原递送至淋巴结。值得注意的是,KK2DP7/OVA的抗肿瘤效果优于常用佐剂。此外,KK2DP7/OVA联合抗PD-1抗体能够在术后复发肿瘤模型中预防肿瘤复发。因此,基于KK2DP7的癌症疫苗单独或与免疫检查点阻断疗法联合治疗肿瘤或术后肿瘤复发是增强抗肿瘤免疫的有力策略。

肿瘤疫苗具有特异性高、毒性低、副作用少等特点,是替代或辅助传统疗法以提高抗肿瘤疗效的优良选择。提高疫苗的体内免疫刺激作用是肿瘤免疫治疗领域的重要研究方向。适应性免疫应答主要在次级淋巴器官中启动,而疫苗在淋巴结(LNs)中的有效积累是癌症疫苗诱导强大的抗原特异性免疫应答的先决条件。LN是抗原呈递的主要部位,存在大量抗原呈递细胞(APCs),这些细胞与初始T细胞相邻,可以在抗原摄取后实现快速抗原呈递。因此,将肿瘤疫苗有效递送到LN是提高疫苗疗效的重要策略。
目前,肿瘤疫苗向LN的有效递送主要依赖于纳米递送系统。由于纳米技术具有被APCs捕获这一固有特性,使用纳米技术进行癌症疫苗设计前景广阔。然而,目前的纳米疫苗系统在实现有效的肿瘤治疗方面仍然存在障碍,主要由于疫苗载体的单一功能设计无法满足临床需要。大多数载体不具备免疫佐剂的功效,其复杂的合成过程不利于后续的大规模使用。有研究表明,一些新的递送系统能够实现给药、佐剂及靶向淋巴结的三重功能,但其合成工艺仍然复杂,不利于转化研究过程中的质量控制和大规模制备。因此,迫切需要开发一种新型多功能递送系统,该系统易于制备,且集免疫佐剂和淋巴结特异性靶向给药功能于一体。
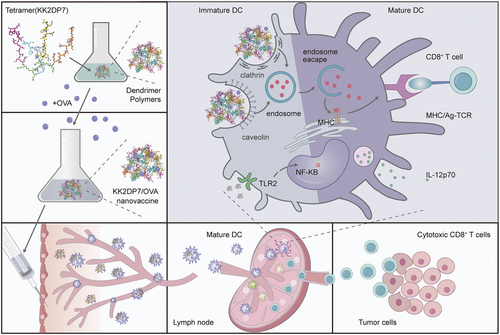
具有淋巴结靶向的多功能纳米疫苗的癌症免疫治疗示意图(摘自Advanced Science )
研究人员设计了一种简单的树枝状纳米颗粒系统(KK2DP7)作为新型癌症治疗性纳米疫苗,以增强基于OVA的疫苗免疫功效。DP7(VQWRIRVAVIRK)是一种新型阳离子亲水抗菌肽,基于该团队已有研究中的氨基酸活性预测方法开发。随后用胆固醇修饰了DP7,发现DP7-C具有递送载体和免疫佐剂的双重功能。虽然先前的实验已经证明DP7-C可用于增强负载抗原DC疫苗的抗肿瘤作用,但由于树突状细胞(DC)疫苗在体外制备复杂且耗时,研究人员认为DP7-C与抗原直接孵育给药可使疫苗在患者体内更快的发生作用。不幸的是,DP7-C与抗原复合后没有明显的LN靶向效应。
因此,该研究设计了LN靶向性增强的树状大分子KK2DP7聚合物纳米疫苗系统。作为一种递送载体,KK2DP7可以通过小窝蛋白和网格蛋白依赖的途径将OVA有效地递送到BMDCs;作为一种免疫佐剂,其可以通过激活TLR2-NF-κB信号通路来刺激BMDC成熟。此外,KK2DP7/OVA进入LN是通过DC的转运实现的。在动物实验中,KK2DP7/OVA的抗肿瘤效果优于常用的佐剂(聚(I: C)、CpG和铝/OVA佐剂等)。此外,KK2DP7/OVA联合抗PD-1抗体在术后复发肿瘤模型中表现出优异的抗肿瘤效果,能够预防肿瘤复发,KK2DP7/新抗原联合抗PD-1抗体在LL2肿瘤模型中也表现出优异的抗肿瘤效果。因此,基于KK2DP7的癌症疫苗单独或与免疫检查点阻断(ICB)疗法联合治疗肿瘤是增强抗肿瘤免疫力的通用策略。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


