Nature:重大进展!揭示免疫细胞ILC3在协助免疫系统对肠道益生菌产生耐受性中起着重要作用
来源:生物谷原创 2022-09-20 08:51
在一项新的研究中,来自美国威尔康奈尔医学院等研究机构的研究人员发现一群称为3型天然淋巴细胞(ILC3)的免疫细胞在建立对定居在人类胃肠道中的共生微生物的耐受性方面发挥着重要作用。
在一项新的研究中,来自美国威尔康奈尔医学院等研究机构的研究人员发现一群称为3型天然淋巴细胞(group 3 innate lymphoid cell, ILC3)的免疫细胞在建立对定居在人类胃肠道中的共生微生物的耐受性方面发挥着重要作用。这一发现阐明了肠道健康和粘膜免疫的一个重要方面---这可能是更好地治疗炎症性肠病(IBD)、结肠癌和其它慢性疾病的关键。相关研究结果于2022年9月7日在线发表在Nature期刊上,论文标题为“ILC3s select microbiota-specific regulatory T cells to establish tolerance in the gut”。

论文通讯作者、威尔康奈尔医学院医学微生物学与免疫学副教授Gregory F. Sonnenberg说,“作为这项新研究的一部分,我们确定了一条驱动对胃肠道微生物群的免疫耐受的新途径。这是我们对粘膜免疫力理解的一个根本性进展,可能是理解免疫系统在IBD等疾病中开始不适当地攻击微生物群时出问题的关键。”
科学家们早就知道,数万亿个细菌、真菌和其他微生物共生在哺乳动物的肠道中。免疫系统通常耐受这些“有益的”肠道微生物,而不是攻击它们,其机制还没有得到很好的理解。但有证据表明,这种耐受性在IBD中受到破坏,导致有害的肠道炎症爆发。因此,对肠道免疫耐受性的详细了解可能使开发强大的IBD新疗法成为可能。IBD包括克罗恩病和溃疡性结肠炎,仅在美国就影响了几百万人。
在这项新的研究中,Sonnenberg及其同事们使用单细胞测序和荧光成像技术来描述排出健康小鼠肠道的肠系膜淋巴结中的免疫细胞。他们专注于表达转录因子RORγt的免疫细胞,这些免疫细胞已知会在对肠道内定植的微生物作出反应时驱动炎症或耐受。他们发现,这些组织中主要的免疫细胞类型是T细胞和ILC3。后者是一个免疫细胞家族,在肠道和肺部等粘膜组织中作为第一道防线发挥作用。
通过与英国伯明翰大学的研究人员密切合作,Sonnenberg及其研究团队观察到,在称为滤泡间区(interfollicular zone)的淋巴结区域,ILC3与一种特定类型的T细胞---称为RORγt+调节性T细胞(Treg)---密切相互作用,从而适应于抑制炎症和免疫活动,以促进肠道中的耐受性。
论文共同作者、伯明翰大学免疫学与免疫疗法研究所免疫调节教授David R. Withers说,“我们以前确定了ILC3在调节适应性免疫中的关键作用,但这些新的发现令人兴奋,因为它们引发了一个概念,即ILC3直接与Treg相互作用以控制肠道的免疫耐受性。”
这些作者接下来发现ILC3在促进肠道中的RORγt+ Treg群体方面发挥着重要作用。与对致病微生物产生的免疫反应一样,ILC3呈递定植在肠道中的微生物的蛋白片段;但这触发了专门识别这些微生物的RORγt+ Treg,而不是炎症性免疫反应。这些RORγt+Treg然后抑制其他T细胞反应,并执行对微生物群的耐受性。
这些作者发现,当他们剔除ILC3用来呈递微生物抗原的表面分子---MHC II型(MHC-II),从而阻止ILC3与RORγt+ Treg之间的相互作用时,观察到的RORγt+ Treg在数量上显著低于正常小鼠,而且受影响的小鼠出现自发性肠道炎症。与此同时,这些小鼠体内的炎症性RORγt+T细胞---即辅助性T细胞17(Th17)---急剧增加,部分原因是许多Treg在失去了来自ILC3的正常信号后,变成了Th17细胞。
论文共同第一作者、Sonnenberg实验室博士后研究员Mengze Lyu说,“我们的广泛研究显示,ILC3是对肠道微生物免疫耐受的必要和充分的执行者。此外,我们现在对ILC3用来与T细胞沟通并驱动微生物特异性Treg产生的信号有了复杂的了解。”
为了证实与人类的潜在相关性,这些作者分析了儿童IBD患者或健康人的发炎肠道组织样品。他们发现有证据表明ILC3和RORγt+ Tregs之间的沟通在IBD患者中受到破坏。
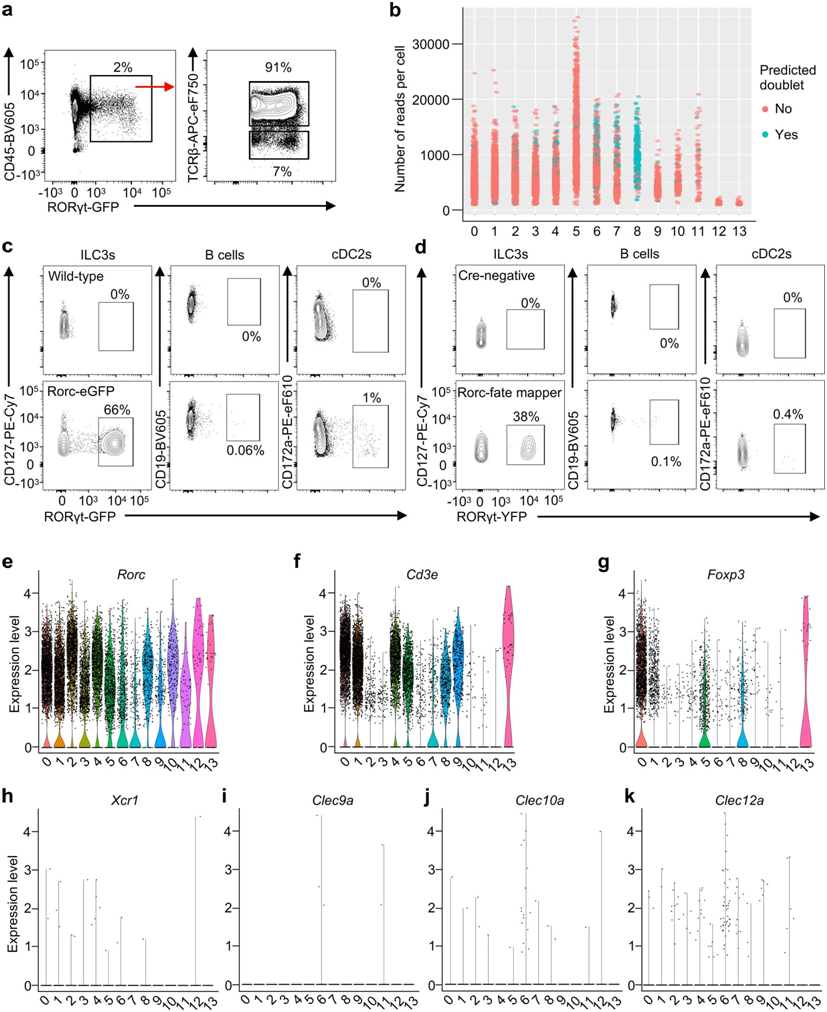
小鼠mLN RORγt+细胞的scRNA-seq分析。图片来自Nature, 2022, doi:10.1038/s41586-022-05141-x。
论文共同作者、威尔康奈尔医学院临床儿科教授Robbyn E. Sockolow博士说,“我们令人兴奋的结果为IBD患者的免疫耐受性受损提供了一个潜在的解释,这可能引发新的疗法,目的是重新教育免疫系统,以便限制针对微生物群的慢性炎症。”
Sonnenberg及其同事们如今正试图确定ILC3-T细胞耐受机制如何区分共生的、有益的微生物和致病的微生物。但到目前为止的结果表明,未来恢复ILC3功能的细胞疗法可能对抑制IBD中的炎症有强大的作用。此外,正如Sonnenberg实验室最近在多发性硬化症小鼠模型中所证明的那样,这一途径仍有可能被用来限制其他炎症和自身免疫性疾病。
Sonnenberg指出,“ILC3是通过促进抗原特异性Treg产生来协调耐受性的关键,这一事实特别重要,因为它表明了开发可以精确地抑制不适当的免疫活动的来源而不损害整体的免疫力的高度针对性治疗的可能性。”(生物谷 Bioon.com)
参考资料:
Mengze Lyu et al. ILC3s select microbiota-specific regulatory T cells to establish tolerance in the gut. Nature, 2022, doi:10.1038/s41586-022-05141-x.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


