Cell Metab | 黎明治疗效果好?中山大学刘强等团队发现睡眠不足导致癌症的潜在机理
来源:生物探索 2024-05-23 11:37
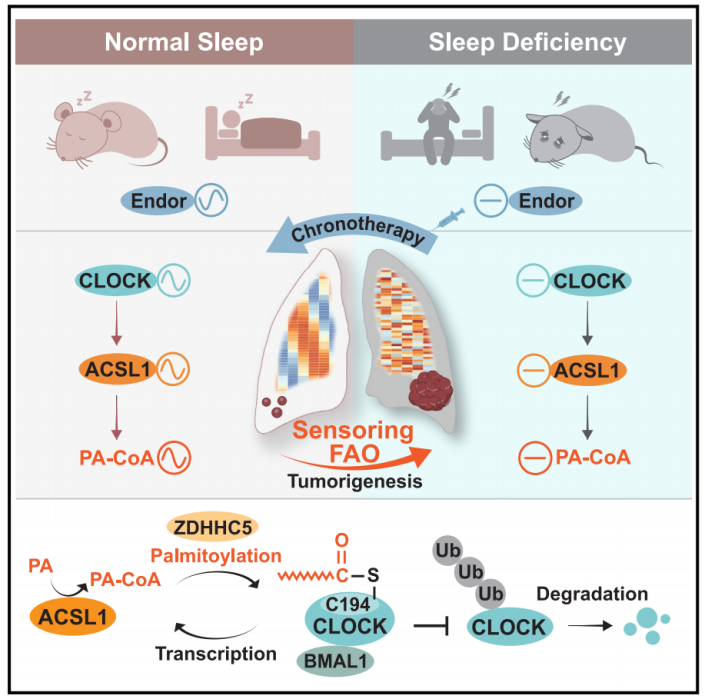
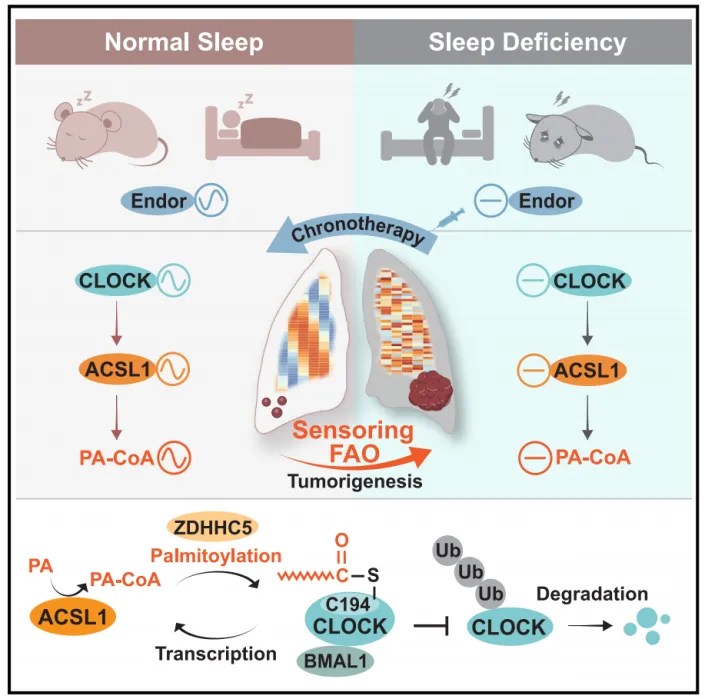
该研究结果表明,FAO是一种昼夜节律感知机制,将SD与肺肿瘤发生联系起来,并为SD相关癌症患者提供了一种有希望的使用β-内啡肽的时间治疗策略。
中山大学刘强及Cui Bai共同通讯在Cell Metabolism 在线发表题为“Oncogenic fatty acid oxidation senses circadian disruption in sleep-deficiency-enhanced tumorigenesis”的研究论文,该研究发现致癌脂肪酸氧化感知睡眠缺陷增强肿瘤发生的昼夜节律紊乱。该研究表明,在SD增强的肺肿瘤发生过程中,脂肪酸氧化(FAO)作为一个昼夜节律传感器,从时钟中断传递到致癌代谢信号。无偏性转录组学和代谢组学分析均显示,FAO感知到SD引起的昼夜节律中断,如由长链脂肪酰基辅酶A合成酶1 (ACSL1)催化的棕榈酰辅酶A (PA-CoA)持续增加所示。
在机制上,SD失调的CLOCK超激活ACSL1产生PA-CoA,从而以依赖ZDHHC5的方式促进CLOCK-Cys194 S-棕榈酰化。这种正转录-棕榈酰化反馈回路阻止了CLOCK的泛素-蛋白酶体降解,导致FAO感知的昼夜节律中断,以维持SD增强的癌症干性。有趣的是,定时β-内啡肽重置节律Clock和Acsl1的表达,以减轻SD增强的肿瘤发生。睡眠质量和血清β-内啡肽与癌症患者的癌症发展和CLOCK/ACSL1表达呈负相关,提示黎明补充β-内啡肽是SD相关癌症的潜在时间治疗策略。

昼夜节律通过环境的光暗周期、行为的进食-禁食和睡眠-觉醒周期来同步,以维持生理稳态。昼夜节律紊乱是现代生活方式的一个显著特征。睡眠不足会扰乱昼夜节律,引发许多病理过程,包括免疫功能障碍、代谢紊乱,甚至过早死亡。越来越多的证据表明,睡眠不足(SD)刺激癌症转移、肿瘤生长和癌症免疫逃逸。此外,哺乳动物的新陈代谢具有昼夜节律性在癌症进展过程中,昼夜节律紊乱改变了许多代谢过程的振荡,包括葡萄糖、谷氨酸、胆汁酸和脂质代谢。然而,代谢重新布线如何感知节律中断来决定SD增强的癌症发展仍不清楚。
脂肪酸氧化(FAO)利用脂肪酸转化的乙酰辅酶A (CoA)亚基生成烟酰胺腺嘌呤二核苷酸(NADH)、乙酰辅酶A和三磷酸腺苷(ATP),支持能量生产、氧化还原稳态和生物合成反应。FAO相关代谢酶和代谢物表现出生物节律来维持体内平衡的生理功能。此外,与FAO有关的酶和代谢物振荡受损在肥胖症、心力衰竭和酒精性肝病等多种疾病中普遍存在。值得注意的是,失调的FAO促进肿瘤转移、耐药和免疫逃逸。这些恶性特征很大程度上归因于癌症干细胞,这是一小群能够自我更新并分化成多种癌症细胞类型的肿瘤起始细胞。然而,人们对FAO节律紊乱在维持癌症发病率方面的重要作用知之甚少。
模式图(Credit: Cell Metabolism)
长链脂肪酸酰基辅酶A合成酶(ACSLs)是FAO中的限速酶,用于酯化长链脂肪酸(LCFAs;(12-20个碳)产生脂肪乙酰辅酶A。单位ACSL1是ACSL家族成员之一,在多种类型的癌症中高度表达,并刺激FAO、线粒体呼吸和ATP的产生,从而促进癌症的进展。ACSL1还将棕榈酸转化为棕榈酰辅酶A,从而驱动蛋白棕榈酰化,其失调有助于肿瘤发生。此外,ACSL1节律性的丧失通过脂质代谢失调促进2型糖尿病和非酒精性脂肪肝疾病。然而,ACSL1节律中断在肿瘤发展中的作用和机制在很大程度上是未知的。
该研究表明FAO感觉昼夜节律中断加剧了SD下的肺肿瘤发生。此外,SD干扰核心昼夜节律基因CLOCK的节律振荡,使ACSL1超反激活,从而加速FAO增强癌症干细胞和肿瘤生长。反过来,ACSL1合成的PA-CoA诱导ZDHHC5介导的Cys194位点的CLOCK S-棕榈酰化,通过抑制泛素蛋白酶体降解来稳定CLOCK蛋白。β-内啡肽节律的恢复可恢复受损的CLOCK和ACSL1振荡,从而逆转SD促进的FAO紊乱和癌症发生。总之,该研究结果表明,FAO是一种昼夜节律感知机制,将SD与肺肿瘤发生联系起来,并为SD相关癌症患者提供了一种有希望的使用β-内啡肽的时间治疗策略。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


