Nature Medicine:异体CAR-T细胞疗法!为复发性神经母细胞瘤带来转机
来源:生物探索 2025-01-23 12:52
ALLO_GD2-CART01是一种创新的异体CAR-T细胞疗法,专门针对神经母细胞瘤(NB)细胞表面特有的GD2分子进行治疗。
神经母细胞瘤(neuroblastoma,NB)是一种起源于神经系统的恶性肿瘤,尤其在儿童中较为常见。尽管现有治疗方法已经取得了一些进展,但对于一些高风险的神经母细胞瘤(HR-NB)患者,尤其是那些在常规治疗后出现复发或耐药的患者,治疗效果仍然非常有限。传统治疗方案,如化疗、放疗以及干细胞移植等,往往只能延缓病情进展,但无法根治这些难治性疾病。特别是在疾病复发或治疗无效的情况下,患者的生存率急剧下降,长期无病生存的几率通常低于15%。
近年来,免疫疗法特别是CAR-T细胞治疗的出现,为癌症治疗带来了新的曙光。CAR-T(嵌合抗原受体T细胞)治疗通过将患者自身的T细胞基因改造,使其能识别并攻击癌细胞,从而极大地提升了治疗的精准性与效果。然而,对于一些高风险神经母细胞瘤患者,传统的自体CAR-T细胞治疗(AUTO_GD2-CART01)仍面临一些挑战,主要体现在患者体内T细胞数量不足或疗效未达到预期。因此,研究人员开始探索使用“异体”CAR-T细胞治疗,即通过健康捐献者提供的T细胞制造CAR-T细胞,以期解决这一问题。
1月15日Nature Medicine的研究报道“Donor-derived GD2-specific CAR T cells in relapsed or refractory neuroblastoma”,该临床研究显示,异体GD2靶向CAR-T细胞(ALLO_GD2-CART01)为多次复发或耐药的神经母细胞瘤患者提供了新的治疗选择。该研究通过在五名多次治疗失败的儿童患者中应用ALLO_GD2-CART01,发现该疗法不仅能够诱导出部分患者的完全缓解(CR)或稳定病情(SD),而且具有较好的耐受性和安全性。尤其是,对于那些之前无法获得自体CAR-T细胞的患者,异体CAR-T细胞的使用展示了其重要的临床价值和治疗潜力。
该研究的结果为异体CAR-T细胞治疗在高风险神经母细胞瘤中的应用开辟了新的方向,也为其他类型癌症的免疫疗法提供了宝贵的经验。随着研究的深入,ALLO_GD2-CART01疗法的安全性、有效性和广泛应用潜力将成为癌症治疗领域的重要突破。

神经母细胞瘤:儿童癌症中的隐形杀手
神经母细胞瘤(Neuroblastoma,NB)是一种来源于交感神经系统的恶性肿瘤,通常发生在儿童的腹部、胸部、脖子以及骨髓等部位。它是最常见的儿童外周神经肿瘤,通常影响五岁以下的儿童。尽管其发生机制尚不完全明了,但研究表明,神经母细胞瘤的发生与基因突变、细胞增殖失控以及神经发育过程中异常细胞的积聚密切相关。特别是MYCN基因扩增被认为是预测疾病预后最重要的分子标志之一,具有高风险的MYCN扩增型患者,病情常表现为肿瘤生长迅速且侵袭性强。
在高风险神经母细胞瘤患者中,肿瘤经常在早期扩散至骨髓和其他远端器官,给治疗带来极大的挑战。即便采用了手术切除、放疗和化疗等综合治疗手段,许多患者仍然无法获得长时间的缓解,且容易复发。因此,对于这类患者,寻找新的、更加有效的治疗方法至关重要。
尽管现有的治疗方法在一定程度上提高了神经母细胞瘤患者的生存率,但对于那些高风险患者,治疗依然面临诸多困境。高风险患者常常经过多轮治疗后依然出现病情复发或耐药,导致治疗效果大打折扣。根据研究数据,50%-60%的高风险神经母细胞瘤患者在传统治疗后仍然无法控制病情,复发的几率较高,这使得这些患者的长远生存率持续低迷,通常不会超过10%-15%。
化疗和放疗是传统的治疗手段,但它们往往伴随着严重的副作用,如免疫力下降、器官损伤等,尤其是在长期治疗过程中。自体干细胞移植虽然能够在一定程度上恢复免疫系统的功能,但在免疫缺陷严重的患者中效果有限。尤其对于那些因病情严重而无法获得足够自体免疫细胞的患者,传统治疗方法的局限性愈加显著。
免疫疗法的崛起:改变癌症治疗的未来
免疫疗法是一种通过激活和增强患者免疫系统的功能来对抗癌症的新型治疗方法。在免疫系统中,T细胞是关键的战士,负责识别并摧毁体内的病变细胞,包括癌细胞。癌细胞常常通过改变自身特性,逃避免疫系统的监视,这使得传统的免疫反应难以有效识别和清除癌症。然而,近年来,研究人员发现通过工程化改造T细胞,可以使其具备更强的识别和攻击癌细胞的能力,这便是CAR-T(Chimeric Antigen Receptor T-cell)技术的核心。
CAR-T细胞疗法通过将患者的T细胞提取出来,在实验室中通过基因工程修改,使其表达一种特殊的“嵌合抗原受体”(CAR),从而赋予T细胞识别癌细胞特定标志物的能力。这些修饰过的T细胞被重新注入患者体内,能准确识别并摧毁癌细胞,极大地提高了免疫治疗的效果。CAR-T技术已在血液系统肿瘤治疗中取得显著进展,尤其是在治疗一些常规疗法无效的白血病和淋巴瘤方面,取得了惊人的成果。
CAR-T细胞的核心原理在于通过人工改变T细胞,使其具备对癌细胞表面特定标志物的识别能力。在神经母细胞瘤等实体肿瘤中,癌细胞表面常常有GD2(神经鞘糖脂)这一特殊的分子标志,研究人员发现,利用这种标志可以开发出针对神经母细胞瘤的CAR-T细胞疗法。
ALLO_GD2-CART01:异体CAR-T细胞的新突破
ALLO_GD2-CART01是一种创新的异体CAR-T细胞疗法,专门针对神经母细胞瘤(NB)细胞表面特有的GD2分子进行治疗。GD2(神经鞘糖脂)是一种常见于多种肿瘤细胞表面的分子,尤其在神经母细胞瘤、骨髓瘤等癌症中高度表达。研究人员发现,GD2分子不仅在癌细胞上表达,而且与肿瘤的生长和转移密切相关。因此,ALLO_GD2-CART01通过设计能够特异性识别并攻击携带GD2分子的癌细胞,从而有效清除肿瘤。
该治疗采用的是异体CAR-T细胞,意味着这些T细胞并非来源于患者自身,而是来自健康的捐献者。经过基因工程改造后,这些捐赠者的T细胞被赋予了识别GD2标志的能力。注射后,这些CAR-T细胞能够迅速扩增,并在体内攻击肿瘤细胞,发挥强大的免疫反应。
研究数据表明,ALLO_GD2-CART01在治疗复发性和难治性高风险神经母细胞瘤的患者中取得了令人鼓舞的效果。几名患者在接受治疗后,出现了显著的病情改善,包括部分缓解和完全缓解。
与自体CAR-T细胞的不同之处:为何异体细胞能成为新的希望
与传统的自体CAR-T细胞疗法(通常利用患者自身的T细胞)相比,异体CAR-T细胞疗法在多个方面具有明显优势。自体CAR-T细胞疗法的主要限制之一是患者的免疫系统可能因多次治疗或疾病本身而处于虚弱状态,导致自体T细胞数量不足,无法制造足够的CAR-T细胞。此外,患者的T细胞可能已因长期治疗而处于“疲劳”状态,导致疗效降低。
而异体CAR-T细胞疗法通过使用健康捐献者的T细胞,克服了这些限制。这些捐赠者的T细胞通常更为健康和充足,能够在体内快速扩增并保持较强的功能。这意味着,异体CAR-T细胞能够提供更多、更强大的免疫细胞,从而增强治疗的效果,特别是对于那些因免疫缺陷或癌症治疗导致免疫系统受损的患者而言,异体疗法提供了一个新的治疗选择。
在ALLO_GD2-CART01的研究中,尽管患者之前的治疗方案已失败,但异体CAR-T细胞依然能够在体内稳定扩增,激活强大的免疫反应。这种疗法展现了极大的潜力,特别是在那些无法从自体细胞获取足够免疫细胞的患者中,异体CAR-T细胞无疑为癌症治疗提供了新的希望和突破。
临床试验数据:ALLO_GD2-CART01在高风险神经母细胞瘤中的应用
ALLO_GD2-CART01的临床试验旨在探索该异体CAR-T细胞疗法在高风险神经母细胞瘤(r/r HR-NB)中的治疗效果。该研究选取了五名高风险的神经母细胞瘤患者,这些患者之前已接受过至少三种不同的治疗方案,包括化疗、自体GD2-CART01治疗、放疗以及干细胞移植等,但均未能有效控制病情。这些患者中,有些因严重的免疫缺陷无法从自身获取足够的T细胞,另一些则因传统治疗失败,成为接受异体CAR-T治疗的候选者。通过这种选择标准,试验专注于探索在常规治疗无效的情况下,ALLO_GD2-CART01是否能为这些患者提供有效的治疗选项。
临床试验的初步结果令人鼓舞。在接受ALLO_GD2-CART01治疗后的五名患者中,四名患者表现出显著的治疗反应,其中包括两名患者实现了完全缓解(CR),一名患者维持了长期的稳定病情(SD),另一名则取得了部分缓解(PR)。尤其是在患者2(Pt2)和患者4(Pt4)身上,尽管他们的病情在接受治疗前处于急剧恶化的状态,仍然成功达到了完全缓解。患者2在接受自体CAR-T治疗后曾取得过短期的稳定,但在转为异体CAR-T治疗后,成功实现了完全缓解,显示出ALLO_GD2-CART01在治疗难治性病例中的独特优势。
这些结果突显了异体CAR-T细胞在克服治疗耐药和复发方面的潜力,尤其是在传统治疗无效的患者群体中。即便是面临极高肿瘤负荷的患者,ALLO_GD2-CART01也能激活免疫反应,提供有效的抗肿瘤效果。
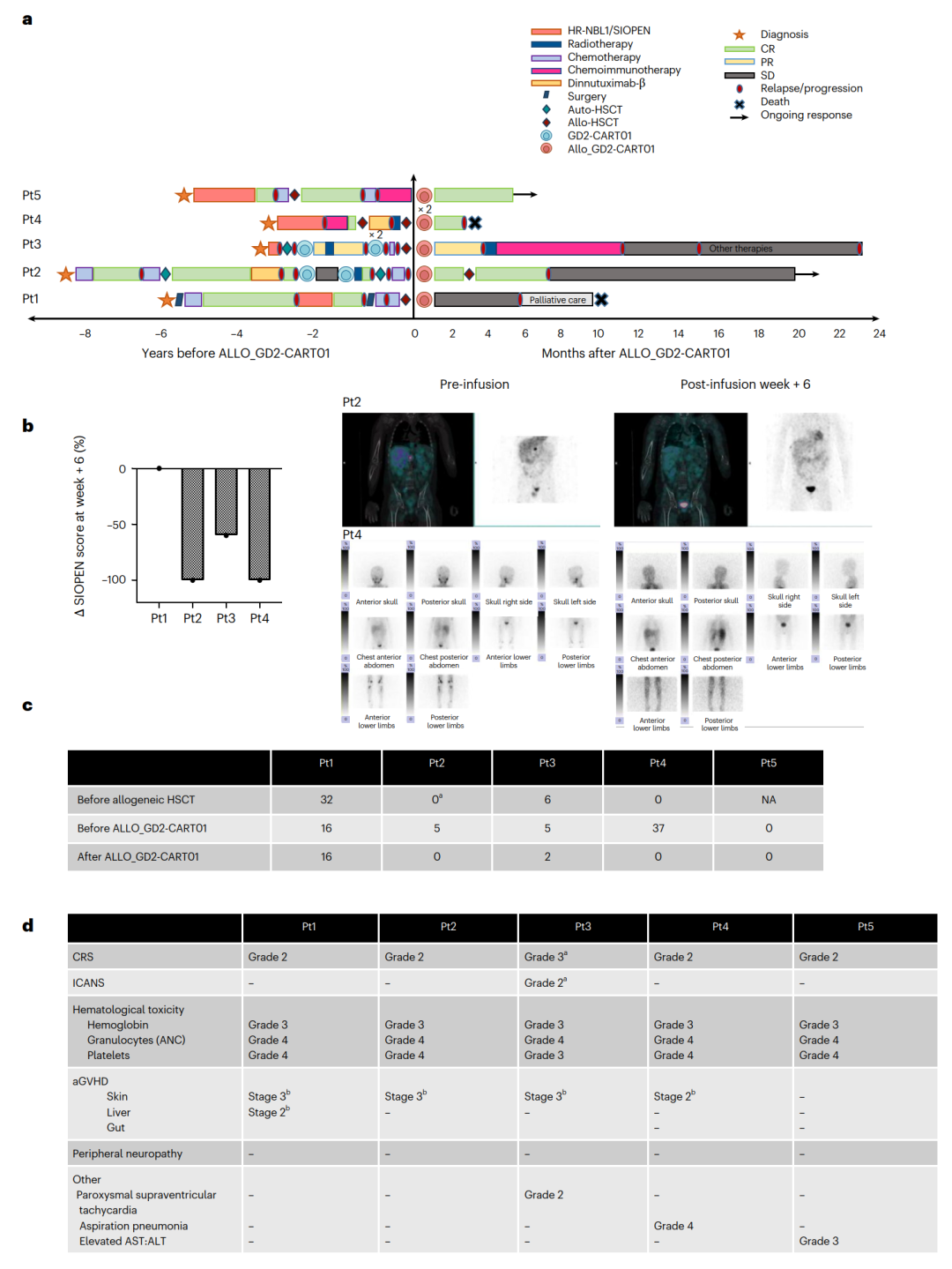
接受ALLO_GD2-CART01治疗的五名复发性或难治性神经母细胞瘤(r/r NB)患者的背景、治疗历史和临床结果(Credit: Nature Medicine)
治疗背景与临床结果概览(图a):
Swimmer plot:展示了五名患者在接受ALLO_GD2-CART01治疗之前的治疗历史,以及治疗后的病情变化。这些患者都接受了高风险神经母细胞瘤(HR-NBL1/SIOPEN)治疗方案,包括诱导化疗、高剂量化疗(HD-chemotherapy)联合自体干细胞移植(auto-HSCT)、手术、放疗以及维持治疗(如dinutuximab-β和CRA)。患者的治疗历史展示了在进入临床试验之前和治疗后的变化情况。
ALLO_GD2-CART01治疗效果(图b):
SIOPEN骨骼评分变化:四名有骨骼病变的患者在接受ALLO_GD2-CART01治疗后6周的SIOPEN骨骼评分变化(相比于治疗前)。这些患者的骨骼病变显示了显著改善,显示出ALLO_GD2-CART01对骨骼转移的有效性。第5名患者在治疗前没有骨骼病变,因此未被纳入评分变化分析。
成像结果:患者2的合并单光子发射计算机断层扫描(SPECT)和MIBG摄取扫描显示了在不同时间点的转移性脊柱病变;患者4则显示出在接受治疗前后的骨骼转移病变和完全缓解(CR)的显著改善。
SIOPEN评分详细信息(图c):
展示了患者在治疗的不同时间点(基线、接受异体HSCT之前、ALLO_GD2-CART01之前和治疗后6周)的SIOPEN评分变化。这些数据反映了治疗的效果,特别是患者2在接受ALLO_GD2-CART01后出现了显著的病情改善。
毒性评估(图d):
根据Lee标准和ASTCT共识评估了患者接受ALLO_GD2-CART01后的毒性反应。主要的副作用包括细胞因子释放综合症(CRS)和急性移植物抗宿主病(aGvHD)。患者的CRS和GvHD分别根据相应的标准进行了分级,并且通过激素治疗得到了有效管理。
治疗后的安全性与耐受性:副作用与管理
尽管ALLO_GD2-CART01展现了显著的治疗效果,但患者在接受治疗后也出现了一些副作用,尤其是细胞因子释放综合症(CRS)和移植物抗宿主病(GvHD)。在所有患者中,都发生了不同程度的CRS,且其中一名患者(Pt3)出现了更为严重的3级CRS,表现为呼吸衰竭,需要使用呼吸机进行辅助治疗。幸运的是,经过激素和托珠单抗治疗,症状得到了有效控制,患者逐渐恢复。
此外,四名患者还经历了不同程度的急性移植物抗宿主病(aGvHD),表现为皮肤和肝脏的损害,但这些症状也通过短期的激素治疗得到控制。值得注意的是,这些副作用虽然较为严重,但都在有效治疗下得到了缓解,未对患者的治疗产生长远的不良影响。
总体而言,ALLO_GD2-CART01在治疗高风险神经母细胞瘤时展现出了强大的疗效,同时其副作用可控,使得其在临床上的应用前景广阔。
基因组学与转录组学:ALLO_GD2-CART01的生物学机制
ALLO_GD2-CART01的成功不仅依赖于其靶向GD2的治疗机制,还在于其强大的细胞扩增能力和持续性。临床研究显示,接受ALLO_GD2-CART01治疗的患者体内,CAR-T细胞在输注后迅速扩增,部分患者的CAR-T细胞水平在短短几天内就达到了高峰。通过流式细胞术和ddPCR分析,研究者们观察到这些细胞在体内的增殖持续性,尤其是在疗程的前几周。具体来说,患者1的CAR-T细胞在输注后达到最高水平,达到每微升89个CAR+ T细胞,而其他患者的扩增水平也达到了相当高的数值,这表明ALLO_GD2-CART01不仅能够迅速扩增,而且其持续存在的能力强,能够长期在体内执行免疫反应。
此外,研究表明,尽管存在免疫耐受性或免疫逃逸的风险,ALLO_GD2-CART01在一些患者体内仍能维持较高的扩增水平,长期发挥作用。这一持久性是治疗成功的关键因素之一,它使得患者能够在更长的时间里保持抗肿瘤的免疫活性。
免疫反应与细胞迁移:ALLO_GD2-CART01的分子特征
ALLO_GD2-CART01的免疫反应机制也通过基因组学和转录组学得到了深刻的揭示。RNA测序结果显示,治疗后的CAR-T细胞表现出了大量与免疫反应相关的基因的上调。例如,涉及T细胞激活、细胞迁移和免疫突触形成的基因在治疗后显著增加。这些基因包括GZMK、WHAMM、RAP1GAP2等,它们与T细胞的细胞毒性、肿瘤细胞的侵入能力和免疫细胞的迁移密切相关。
尤其是,ALLO_GD2-CART01在细胞迁移方面的表现极为突出。通过对转录组数据的分析,研究者发现,ALLO_GD2-CART01细胞在体内扩增后,能够迅速定位至肿瘤部位,表现出明显的肿瘤浸润。这种迁移能力是通过特定的化学趋化因子(如CXCL9、CXCL10)的上调实现的,这些趋化因子能够引导CAR-T细胞向肿瘤区域聚集,从而增强其抗肿瘤活性。细胞迁移能力的提高使得ALLO_GD2-CART01能够有效覆盖并攻击癌症细胞,提升了治疗的整体效果。
前景与挑战:ALLO_GD2-CART01疗法的未来
是否能成为广泛应用的标准治疗?
ALLO_GD2-CART01展现出巨大的临床潜力,尤其是在治疗高风险神经母细胞瘤(r/r HR-NB)方面。这一疗法通过异体CAR-T细胞的强大扩增与持续性、靶向GD2分子并引发强烈免疫反应,使其在患者中取得了显著的治疗效果。临床试验数据表明,ALLO_GD2-CART01能够在治疗失败的患者中产生完全缓解(CR)和部分缓解(PR)的成果,这为癌症治疗带来了新的希望。
然而,尽管ALLO_GD2-CART01表现出色,它是否能成为广泛应用的标准治疗仍面临一些挑战。首先,疗效的普适性和长期效果仍需在更大规模的临床试验中得到验证。虽然部分患者获得了良好的反应,但仍有患者面临病情复发。因此,疗效的稳定性和在不同人群中的适应性仍需进一步观察和评估。
疗效与副作用的平衡
尽管ALLO_GD2-CART01展现了令人振奋的疗效,但它的副作用,尤其是细胞因子释放综合症(CRS)和移植物抗宿主病(GvHD),也是不容忽视的挑战。临床试验中,患者普遍出现了不同程度的CRS和aGvHD,这些副作用虽然可以通过药物治疗得到有效控制,但仍可能影响治疗的耐受性和患者的生活质量。
未来的改进方向包括优化CAR-T细胞的制造过程,提升其在患者体内的持久性和靶向性,减少不必要的免疫反应。此外,引入更精准的预防和治疗策略,如增强安全性基因的使用、改进细胞因子管理,将有助于减少副作用,提升疗效。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


