南京邮电大学研究者们揭示了自体细胞外囊泡生物合成植入物的机电刺激调节肠道菌群
来源:生物谷原创 2024-05-12 11:28
宿主ev在体内细胞和微生物之间的沟通中起着至关重要的作用,并为有效调节微生物群和疾病干预提供了一种新型的天然自体治疗方法。
为了使肠道正常运作,肠道细胞和肠道微生物群落之间的相互作用需要保持在健康的动态稳态中。因此,对这种体内平衡的任何功能失调的扰动都可以引发和促成有害的严重衰弱性疾病,如炎症性肠病(IBD)、神经系统疾病、心血管疾病,甚至癌。其中一个关键的参与者是与这些肠道微生物分子相互作用的巨噬细胞。因此,调节肠道菌群本身为帮助治疗许多相关疾病提供了一个有希望的治疗机会。然而,目前临床上使用同种异体粪便微生物群移植(FMT)进行微生物群调节,对于任何常规患者受体剂量,都存在低质量控制和可持续性问题。
最近,美国食品和药物管理局(fda)对通过FMT无意中转移异体抗生素耐药微生物提出了FMT的安全警告。另一方面,传统的肠道菌群调节方法,如膳食益生菌干预,仍然面临功效限制,因为它们要么定义不清,要么对肠道部位缺乏选择性,因此通常需要高剂量的长期给药才能获得任何可持续的益处。因此,人们对开发具有理想效率的生物安全微生物群调节策略有着浓厚的兴趣。
宿主细胞来源的细胞外囊泡(EVs)携带丰富的核酸、蛋白质和代谢物,作为强大的细胞信使,促进细胞间的通讯和调节。最近对肠道微生物群的研究表明,EVs可以作为远距离非接触实体,在体内架起宿主细胞与微生物群之间沟通的桥梁。已经发现h2t细胞通过直接相互作用和调节细菌的转录和生长,塑造微生物群,并通过富含mirna的ev改善紊乱的微生物群。虽然EVs不是完整的细胞,但它们确实部分再现了其源细胞的生物活性和纳米尺寸,从而使它们具有高度的生物可利用性和组织渗透性。

图片来源:https://doi.org/10.1038/s41467-024-47710-w
近日,来自南京邮电大学新材料研究所的研究者们在Nat Commun杂志上发表了题为“Mechanoelectronic stimulation of autologous extracellular vesicle biosynthesis implant for gut microbiota modulation”的文章,该研究建立的iMASSAGE平台为体内快速制造和释放功能性EV以调节微生物群开辟了可能性。
致病性肠道微生物群是导致衰弱的胃肠道疾病的原因。虽然宿主免疫细胞确实产生细胞外囊泡来抵消微生物群的一些有害影响,但细胞外囊泡的剂量不足,暴露时间也不可靠。在患病肠道的情况下,肠道巨噬细胞与病理微生物群之间存在一些可治疗性的ev介导的交叉通讯。将这些自体ev扩展到有治疗意义的数量是一个巨大的挑战。定制给药时间几乎是不可能的,因为没有药物诱导特异性靶向肠巨噬细胞产生必要的EV负荷。即使能够获得足够的自体EVs,将它们输送到肠道微生物群,特别是小肠和大肠段,是下一个重大的工程问题。自然摄入途径将使EVs受到降解酸性胃成分的影响。
在这里,研究者在生物电子控制器中使用水凝胶嵌入巨噬细胞的机械刺激,根据需要增加高达20倍的治疗性细胞外囊泡的产生,以改善微生物在体内的有害影响。
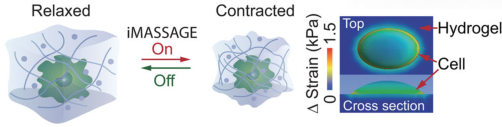
iMASSAGE用于体内EV生产和原位微生物群调节
图片来源:https://doi.org/10.1038/s41467-024-47710-w
微型无线生物电子系统被称为原位和可持续产生细胞外囊泡的诱导机械激活(iMASSAGE),利用无线电子和反应性水凝胶对巨噬细胞施加机械力,产生细胞外囊泡,以纠正肠道微生物群失调并改善结肠炎。这种体内可控的细胞外小泡生成系统有望成为治疗各种其他疾病的平台。
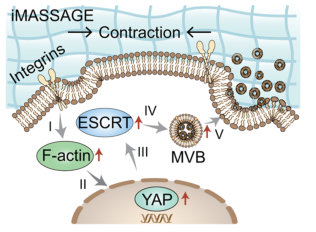
iMASSAGE触发EV生成的示意图
图片来源:https://doi.org/10.1038/s41467-024-47710-w
综上所述,宿主ev在体内细胞和微生物之间的沟通中起着至关重要的作用,并为有效调节微生物群和疾病干预提供了一种新型的天然自体治疗方法。本研究建立的iMASSAGE平台为体内快速制造和释放功能性EV以调节微生物群开辟了可能性,这不仅为EV治疗提供了独特的技术进步,而且提供了一个原位处理,使确定细胞的EV生物发生可控,从而增强了对活生物体中EV介导的细胞间和跨物种通信的理解。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


