Cell:顾名夏/苗一非/郭敏哲团队,在同一个球状体中实现肺和肠道类器官的血管化,成功构建多谱系类器官
来源:类器官学社 2025-08-04 17:19
该研究重现了多个胚层的同时发育,促进了人类发育初期阶段的基本细胞间通信——这是组装体模型所缺乏的一个关键特征。
血管系统和间充质组织展现出适应局部生理需求的独特器官特异性特征,这些特征是在早期发育过程中由微环境和细胞间相互作用塑造而成的。
为了重现这一完整过程,该研究在同一个球状体中共分化中胚层和内胚层,从而利用诱导多能干细胞(iPSC)构建出具有血管化的肺和肠道类器官。
骨形态发生蛋白(BMP)信号通路精细调节了内胚层与中胚层的比例,这是生成具有组织特异性的适当比例的内皮和上皮祖细胞的关键步骤。单细胞RNA测序(scRNA-seq)揭示了内皮和间充质的器官特异性基因特征,并鉴定了驱动内皮分化的关键配体。
该内皮层展现出组织特异性的屏障功能,在工程化肺支架上增强了类器官的成熟度、细胞多样性以及肺泡形成。
将类器官移植到小鼠体内后,其血管系统与宿主循环系统整合,同时保留了器官特异性,进一步促进了类器官的成熟。
利用这些具有血管化的类器官,发现了叉头框F1(FOXF1)突变患者中存在异常的内皮-上皮相互作用。这种多谱系类器官为研究人类器官发生和疾病中复杂的细胞间通讯提供了一个先进的平台。

机制示意图:通过单个球体内中胚层和内胚层的共分化来概括胚层的同时发育,从而能够产生血管化的肺和肠道类器官,揭示了微环境如何引导器官型内皮细胞和间充质细胞的发育。

研究背景
人类发育过程中器官血管化这一复杂且高度相互作用的过程的时空动态机制仍知之甚少。要填补这一知识空白,需要建立体外平台,该平台不仅要包含相关的细胞谱系,还要包含具有适当细胞结构的器官型血管系统。
类器官是模拟器官细胞组成和功能的三维组织结构,创造了适合研究人体发育和疾病的微环境,尤其是器官型血管的发育。
先前的研究尝试通过引入血管生成因子来生成血管化的肠道器官组织,以扩增在内胚层分化过程中偶然出现的少量内皮祖细胞群体,但所形成的血管在数量、结构和功能上仍较为有限,并且常常缺乏器官特异性特征和完整功能。
目前用于生成肺器官组织的方法尚未成功重现人类肺泡毛细血管界面,因为大多数从iPSC分化出前肠和肺器官组织的方案都依赖于对BMP和转化生长因子β(TGF-β)信号的强烈抑制。
虽然这些条件对于内胚层的形态形成是有效的,但它们却与血管和间充质细胞系的特化不相容。因此,肠道和肺组织培养物中缺乏稳定的血管生成极大地限制了它们在疾病建模和治疗应用方面的生理相关性。
该研究利用发育学原理构建了一个体外血管化类器官平台,忠实地再现了中胚层与内胚层谱系的协同发育过程。该方法能够高效地分化与特化内胚层衍生物以及具有器官特异性的内皮细胞和间充质细胞群。
由此生成的血管化肺类器官和肠类器官具有器官特异性的内皮层和间充质组织,展现出更高的细胞类型多样性、三维结构特征、细胞存活率及成熟度。
这种多谱系类器官系统可用于研究多种疾病背景下异常的细胞-细胞相互作用,通过将携带FOXF1突变的患者来源诱导iPSC分化为血管化的肺类器官,成功重现了由于内皮-上皮细胞间通讯中断所导致的原发性内皮缺陷以及继发性上皮异常。
总体而言,血管化的肺类器官和肠类器官为研究器官特异性血管的细胞命运决定以及发育和疾病过程中涉及的细胞-细胞相互作用提供了一个变革性的平台。
研究关键点
1. BMP介导的中胚层-内胚层共分化,并生成器官型血管的的肺和肠道类器官
2. 器官型血管支持内胚层类器官的发育与成熟
3. 血管化类器官具有类似人类胎儿肺和肠道的特征
4. 血管化类器官可模拟FOXF1突变疾病中异常的内皮-上皮细胞互作
关键研究结果
1、精细调控BMP信号以实现内胚层-中胚层共同发育及血管化肺和肠类器官生成
为启动肠管类器官内脉管系统的共同发育,该研究通过在一个3D胚状体(EB)中同步分化相关胚层祖细胞,模拟了人类胚胎早期发育过程。
在确定性内胚层(DE)和中胚层时,需要精确控制BMP信号的激活。长时间暴露于BMP4会略微抑制DE的形成,同时促进表达心脏和神经嵴衍生物1(HAND1)的中胚层的发育。接下来,为了从中内胚层球体生成血管化前肠(vAFG)类器官,发现除了抑制BMP信号外,多谱系类器官内各种细胞类型提供的内源性WNT、FGF、TGF-β和Hedgehog信号,足以在第3至第7天驱动前肠类器官的分化。
为生成血管化的中肠/后肠(vMHG),从第3天至第7天向中-内胚层类球体中引入CHIR99021(CHIR)、FGF4和血管内皮生长因子A(VEGFA),不仅增加了血管比例,同时未削弱小肠上皮特征(CDX2+/GATA4+)(图1A-E)。
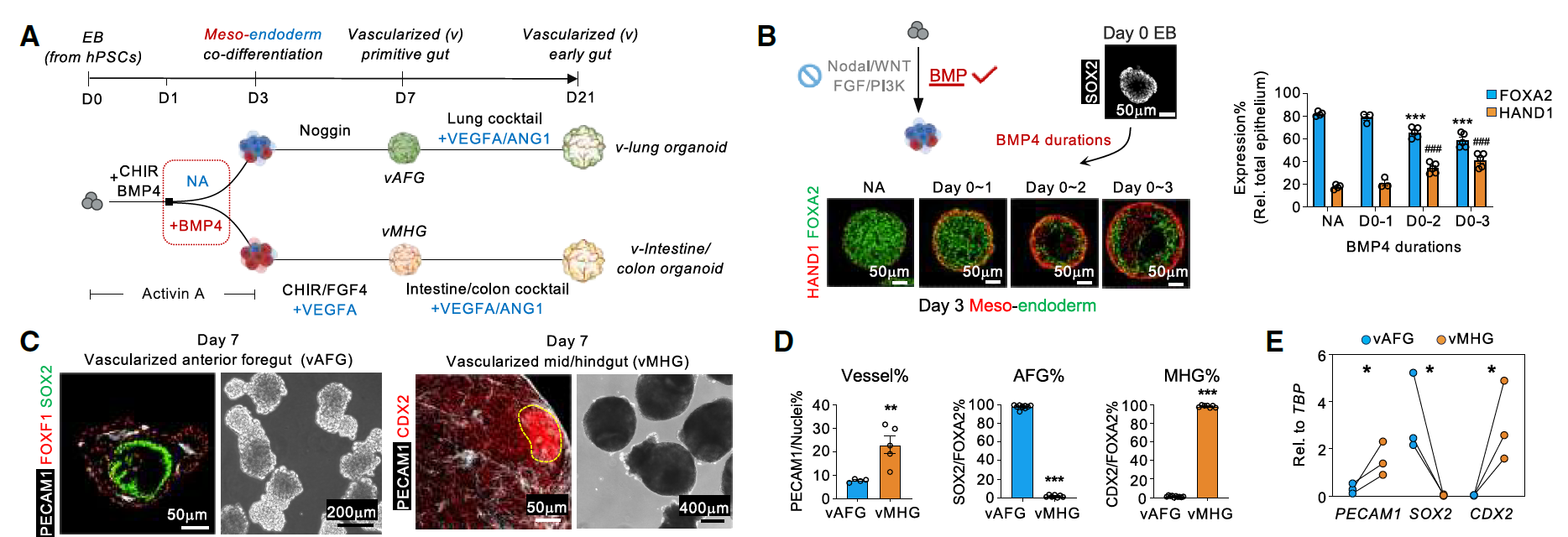
图1
在已建立的vAFG和vMHG的基础上,进一步从第7天到第21天对肺和肠系谱系进行了模式化。在器官形成阶段(第7-21天),将VEGFA和血管生成素1(ANG1)与传统的肺类器官祖细胞培养基联合应用,能够协同增强内皮细胞分化,同时保持血管化人肺祖细胞类器官(vHLPO)中其他肺系谱系的纯度。血小板和内皮细胞黏附分子-1(PECAM-1)阳性的血管内皮细胞与FOXF1阳性的间充质细胞同时出现。值得注意的是,vHLPO中的细胞模式化和排列与胚胎小鼠肺相似。为了定量分析vHLPO的结构,通过测量三维重建图像中每个上皮细胞到血管床表面的最短距离,建立了一个“血管整合指数”。第21天时,vHLPO展现出与胚胎第12.5天(E12.5)小鼠肺相当的血管整合和结构。这种分化过程在多条iPSC系中具有可重复性,而在传统的肺类器官系统中并未观察到上皮、间充质和血管的整合(图1F-N)。
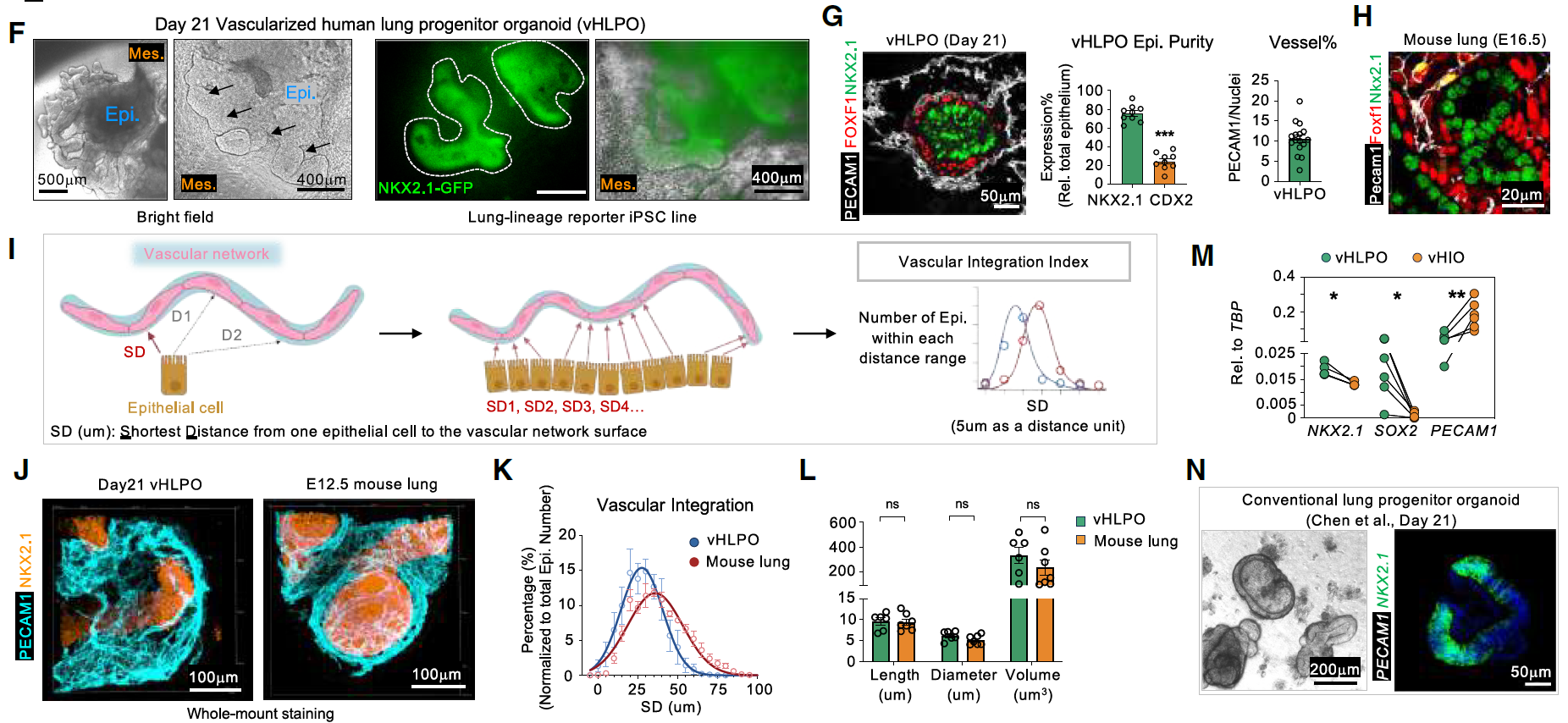
图1
为了生成血管化的人类肠类器官(vHIO)和结肠类器官(vHCO),该研究在传统的小肠或结肠培养基中添加了血管生成因子,以驱动vMHG分化。
与之前需要BMP4与其他血管生成因子一起使用来扩增肠类器官中有限比例的内皮细胞祖细胞的方案不同,该策略仅需要从第7天到第21天添加VEGFA和ANG1,就能有效促进内源性血管的成熟,同时不影响上皮细胞系的身份,并且在不同细胞系中表现出高度的可重复性。
尽管与胚胎小鼠肠相比,vHIO中的血管整合呈现出更紧凑的分布,但血管结构的差异是无法区分的(补充图2I-P)。
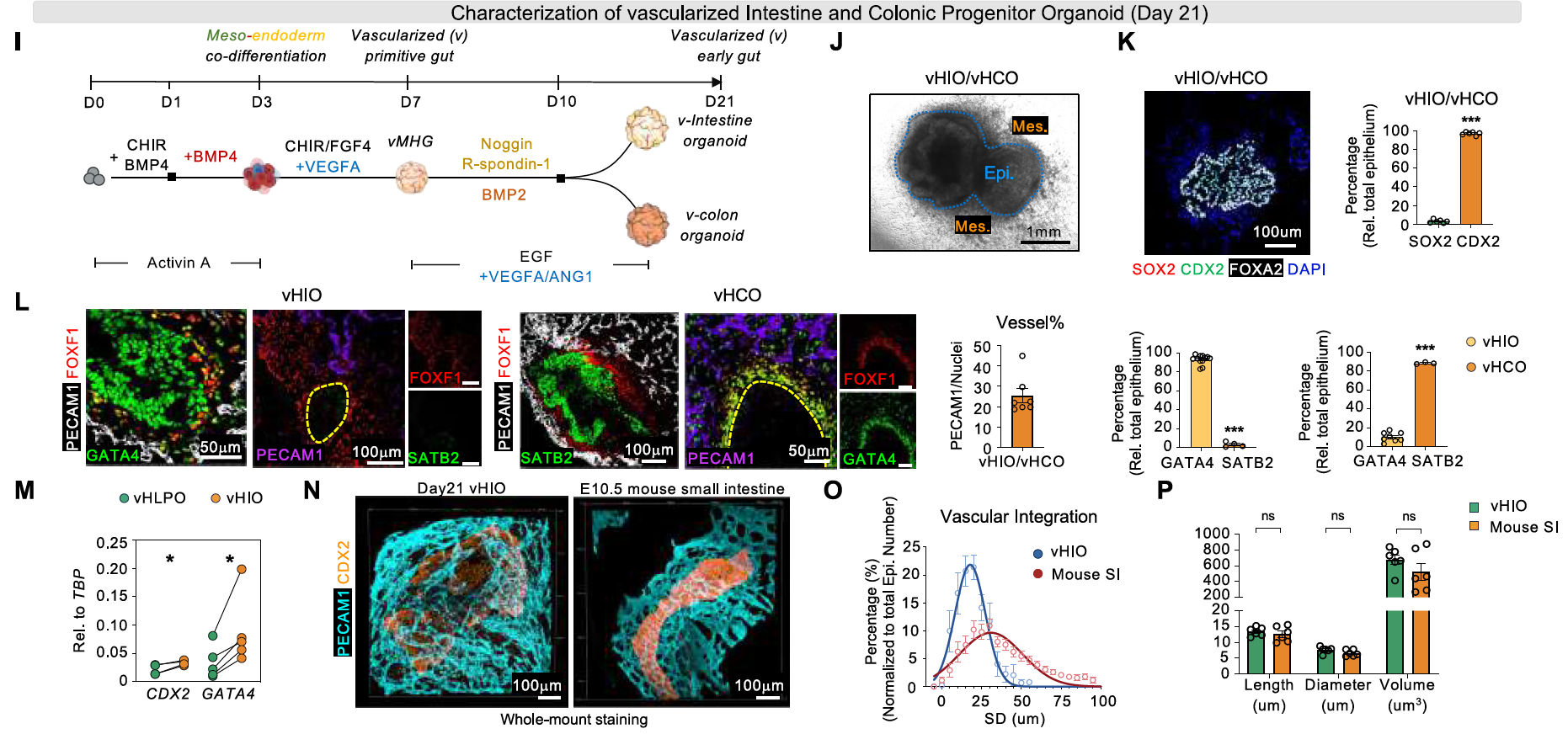
补充图2
在胚胎早期阶段,除了调节中胚层诱导的作用外,从第0天到第1天的BMP激活有利于后续在第21天特异性形成前肠肺系谱系(NKX2.1⁺/CDX2⁻),而从第0天到第3天持续的BMP刺激则促进了后肠肠道命运(CDX2⁺/SOX2⁻)。
接下来对第3天的中内胚层球体进行了scRNA-seq。值得注意的是,投射到人类胚胎内胚层的DE簇表现出多样化特征。
对其在不同BMP4处理持续时间下的分布以及BMP驱动评分的分析表明,前后(A-P)模式化在第3天已经可以被检测到,并且与BMP驱动评分呈正相关。还需要在更多模型中进一步验证以确认这一概念(图1O-S)。
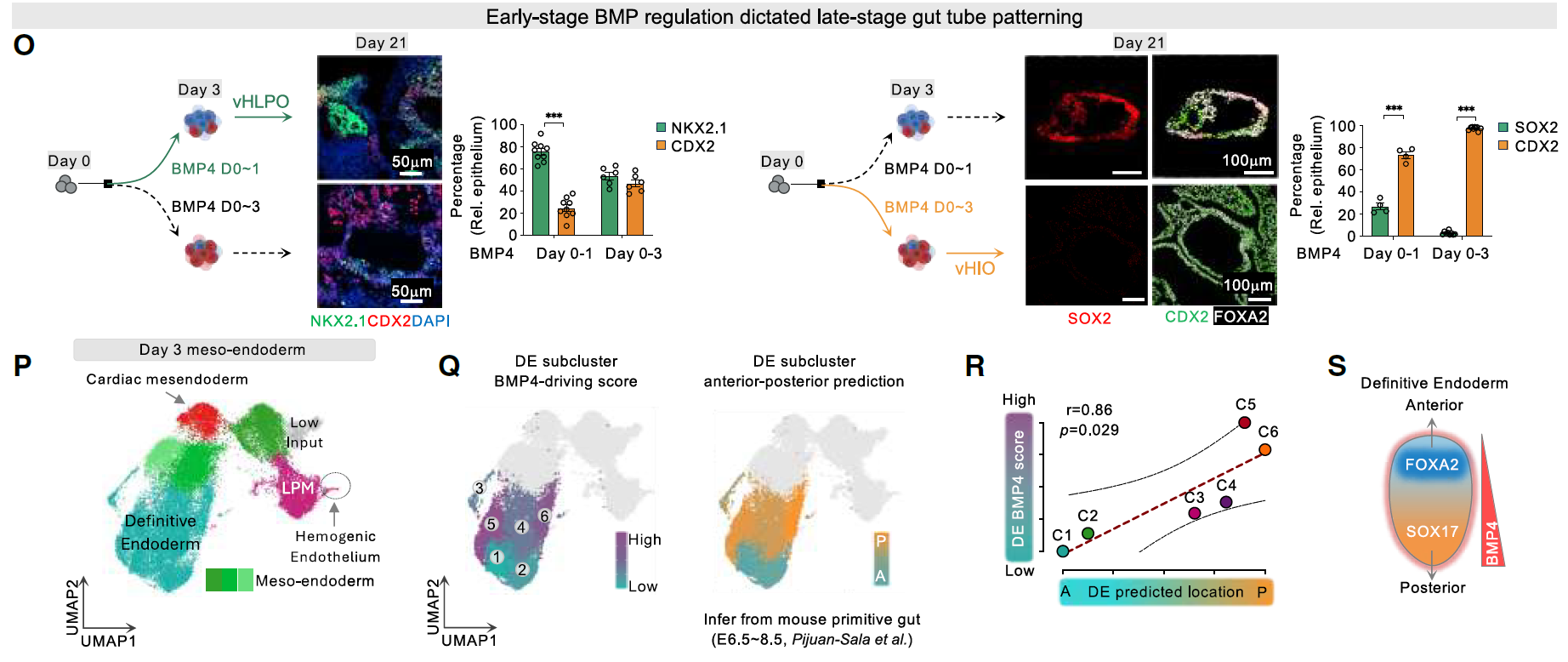
图1
2、血管化肺和肠类器官中的器官特异性内皮层
为了进一步表征血管化类器官中的器官特异性特征,在第21天对vHLPO、vHIO和vHCO进行了scRNA-seq,并基于标志性基因表达识别出丰富的内皮细胞、间充质细胞和上皮祖细胞群体。
细胞类型分布分析显示,与传统的第31天HLPO(0%)、第22天肠类器官(HIO,0.4%)以及第67天肠类器官(2%)相比,目前的方案显著增强了第21天vHLPO中EC的分化效率(7%)以及第21天vHIO/vHCO中内皮细胞的分化效率(9%)。
此外,在血管化类器官中适当血管和间充质的同时出现提高了前肠上皮谱系的纯度:传统HLPO中有34.5%的细胞被肠上皮细胞污染,而vHLPO中仅有1%的细胞为肠上皮细胞。
值得注意的是,vHLPO和vHIO中的细胞组成与人类胎儿肺和小肠在受孕后10-11周时观察到的细胞组成非常相似(图2A-B)。
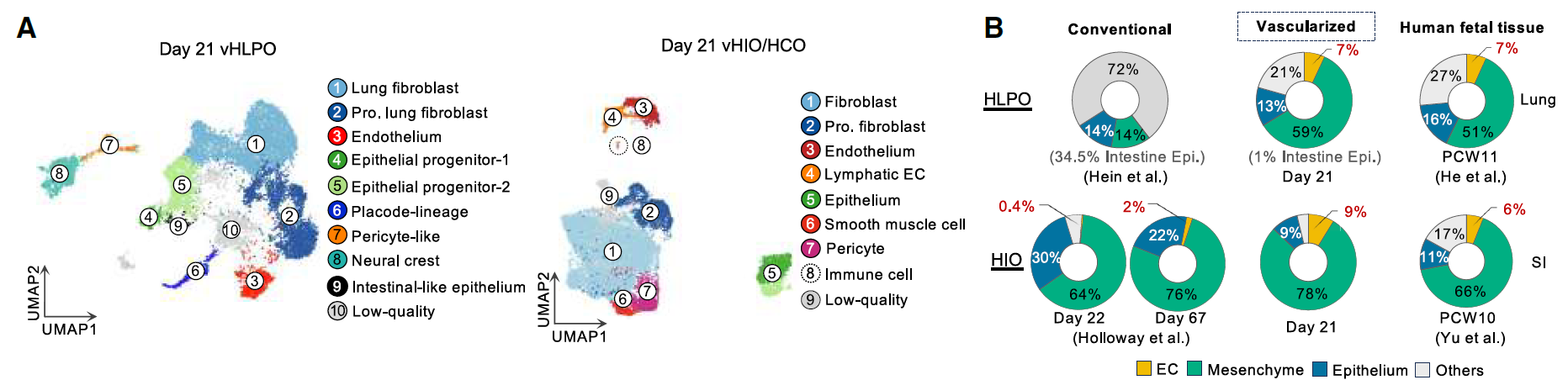
图2
为了评估血管化肺和肠类器官中EC的器官特异性,重新分析了多个独立的人类细胞图谱,并定义了内胚层来源器官中EC的特异性标记物。来自vHLPO、vHIO和vHCO的EC簇整合后显示出器官特异性的分离,其中肺EC与肠EC分别聚集。
此外,类器官EC表达了对应于人类胎儿肺(HPGD和APCDD1)、小肠(STAB1和MTUS1)以及结肠EC(THSD7A和CXXC5)的标记基因。
到第40天,随着进一步成熟,vHLuO表达了远端肺上皮(SOX9⁺/NKX2.1⁺)、II型肺泡细胞(AT2,HTII-280)和I型肺泡细胞(AT1,HT1-56/HOPX/ANKRD1)的标记物,以及肺EC的标记物(HPGD和FENDRR),但在vHIO中没有表达。
相反,与vHLPO相比,人类小肠/结肠EC标记物IGFBP7在vHIO中的表达更为丰富。这些器官特异性特征也在功能水平上得到了体现:与来自vHIO的EC相比,来自vHLPO的EC显示出更高的屏障功能(图2C-I)。
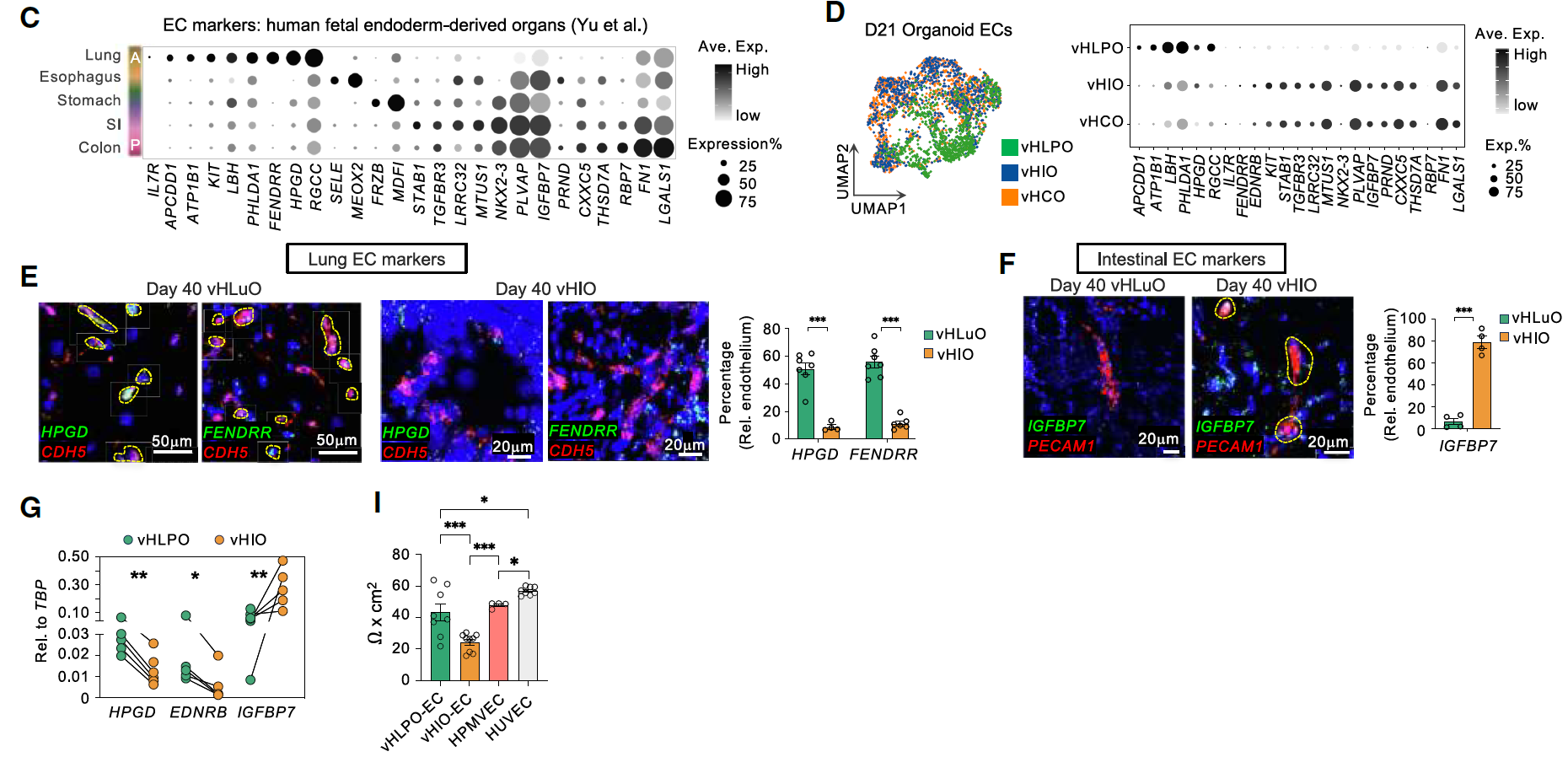
图2
为了识别驱动器官特异性EC发育的微环境信号,对第21天的血管化类器官进行了CellChat分析,并将其与人类胎儿组织进行了比较。这些新鉴定的配体在类器官和人类胎儿组织中均被一致发现,例如来自肠上皮的SEMA4C、来自肠上皮和间充质的IGF2、来自肺间充质的FGF9以及来自肺上皮的SEMA3E。
值得注意的是,一些WNT家族和semaphorin家族的配体更倾向于促进肺EC的特异性分化,而不是肠EC,表明选择性地操纵这些信号通路可能会促进肺EC的分化。
接下来在缺乏明确器官身份的通用三维血管类器官(VO)中评估了这些配体引导器官特异性EC分化的能力。
在将VO分别暴露于候选形态发生素后,发现WNT2B、WNT11、SEMA3C、SEMA6A和SEMA6B能够有效促进肺EC特征的表达,而WNT4、ANGPTL4、TGFB1和GDF15则能够有效引导通用EC向肠细胞命运分化(图2J-K)。
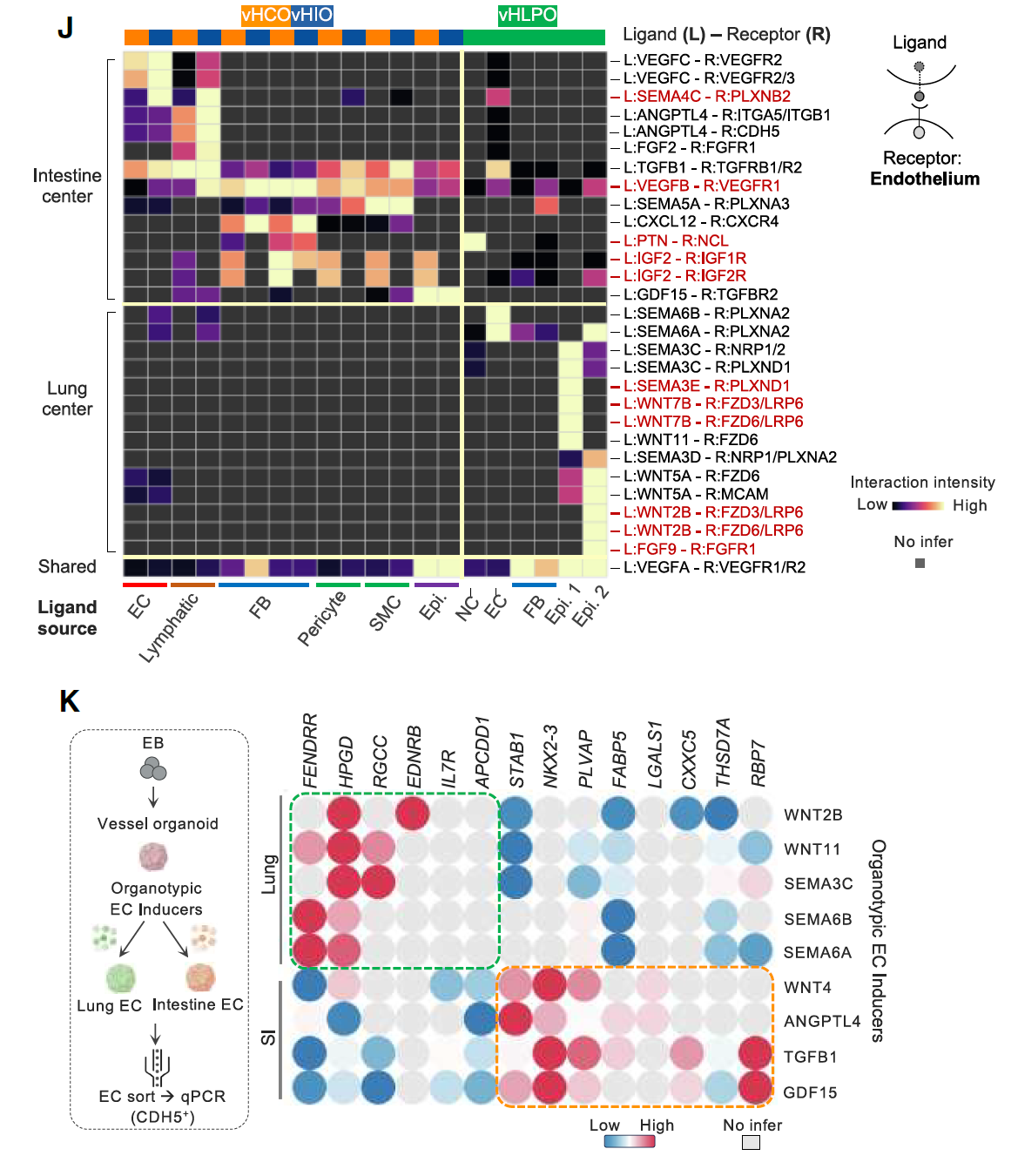
图2
为了进一步评估血管化类器官中EC的可塑性,将EC分离出来并在缺乏周围组织特异性细胞类型的情况下独立培养,结果发现EC迅速失去了原有的组织特异性特征。
当暴露于肠EC诱导因子时,来自vHLPO的肺EC获得了类似肠的特征,反之亦然,这突显了它们对外部信号的高度可塑性(图2L)。
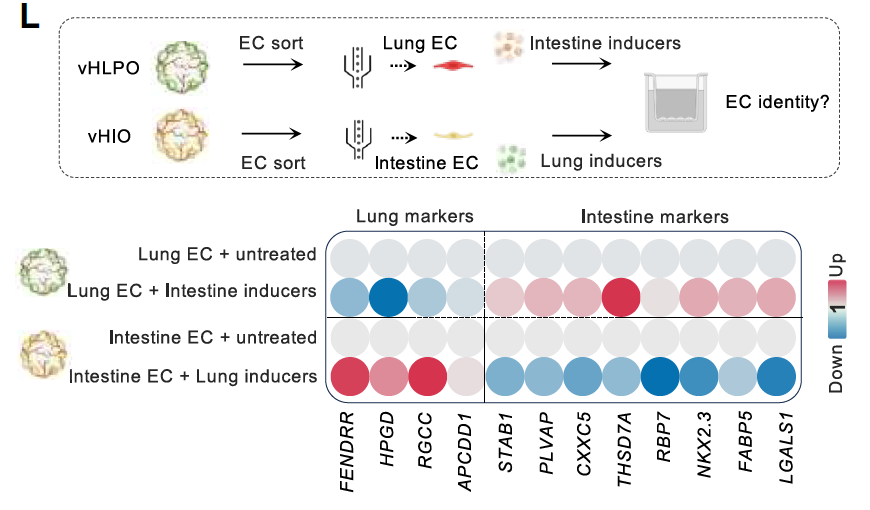
图2
3、血管化肠类器官间充质中的不同器官特异性特征
接下来对类器官分化过程中间充质的器官特异性特征进行表征。在第7天对vAFG和vMHG进行了scRNA-seq,重点关注了vAFG-“B1”和vMHG-“B3”组。
与传统的第10天AFG和第8天后肠相比,目前的方案显著增强了vAFG和vMHG中的间充质和内皮细胞分化。
在vAFG中,与传统AFG分化方案观察到的污染(19.7%)相比,MHG污染可以忽略不计(约0%)。vMHG类器官中的细胞组成分布与E8.75(胚胎第8.75天)小鼠后肠图谱中发现的非常相似,而与E9.0小鼠前肠相比,vAFG类器官包含较少的间充质细胞和更多的EC及上皮细胞(图3A-B)。
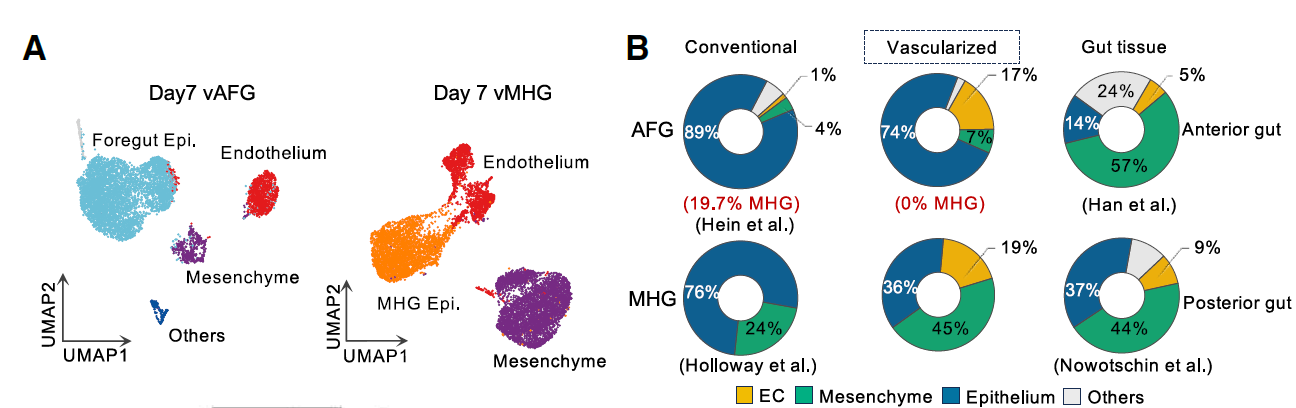
图3
在E8.75小鼠原肠管中,前后(A-P)身份主要在间充质和上皮细胞中观察到,但在EC中不太明显。在第7天的vAFG和vMHG中也发现了类似的前后模式化,间充质和上皮细胞表现出明确的前后身份,但EC没有。
还揭示了区分前后肠管间充质的已知(Hoxb6和Hand1)和新的标记物,这些标记物在物种间或人类特异性中共享(以红色突出显示)。这些结果随后在人类vAFG和vMHG类器官中得到了验证(图3C-G)。
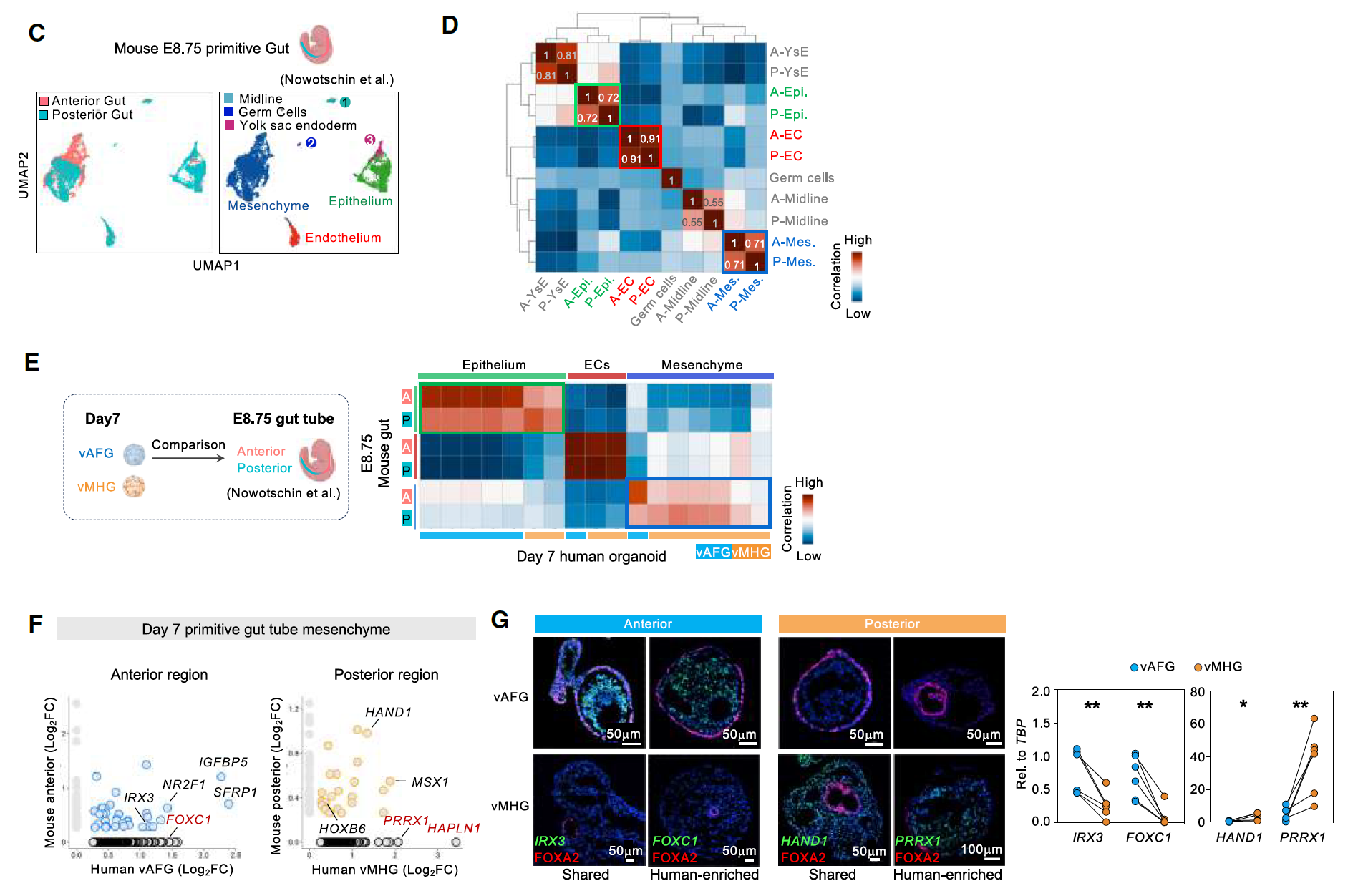
图3
为了进一步确定第21天血管化类器官中间充质的器官特异性特征,首先分析来自人类胎儿内胚层器官的间充质细胞群体,以定义它们的器官特异性。
在整合第21天血管化类器官的间充质细胞后,肺和肠道的间充质群体明显分离,并表达了相应的人类胎儿肠道间充质标记物。相似性分析显示,血管化类器官在沿着前后(A-P)轴的间充质特性方面与人类胎儿肠道组织高度相似。
对肺特异性标记物TBX4和肠特异性标记物IGFBP7单的分子荧光原位杂交(smFISH)染色进一步验证了vHLPO和vHIO间充质的器官特异性特征(图3H-O)。
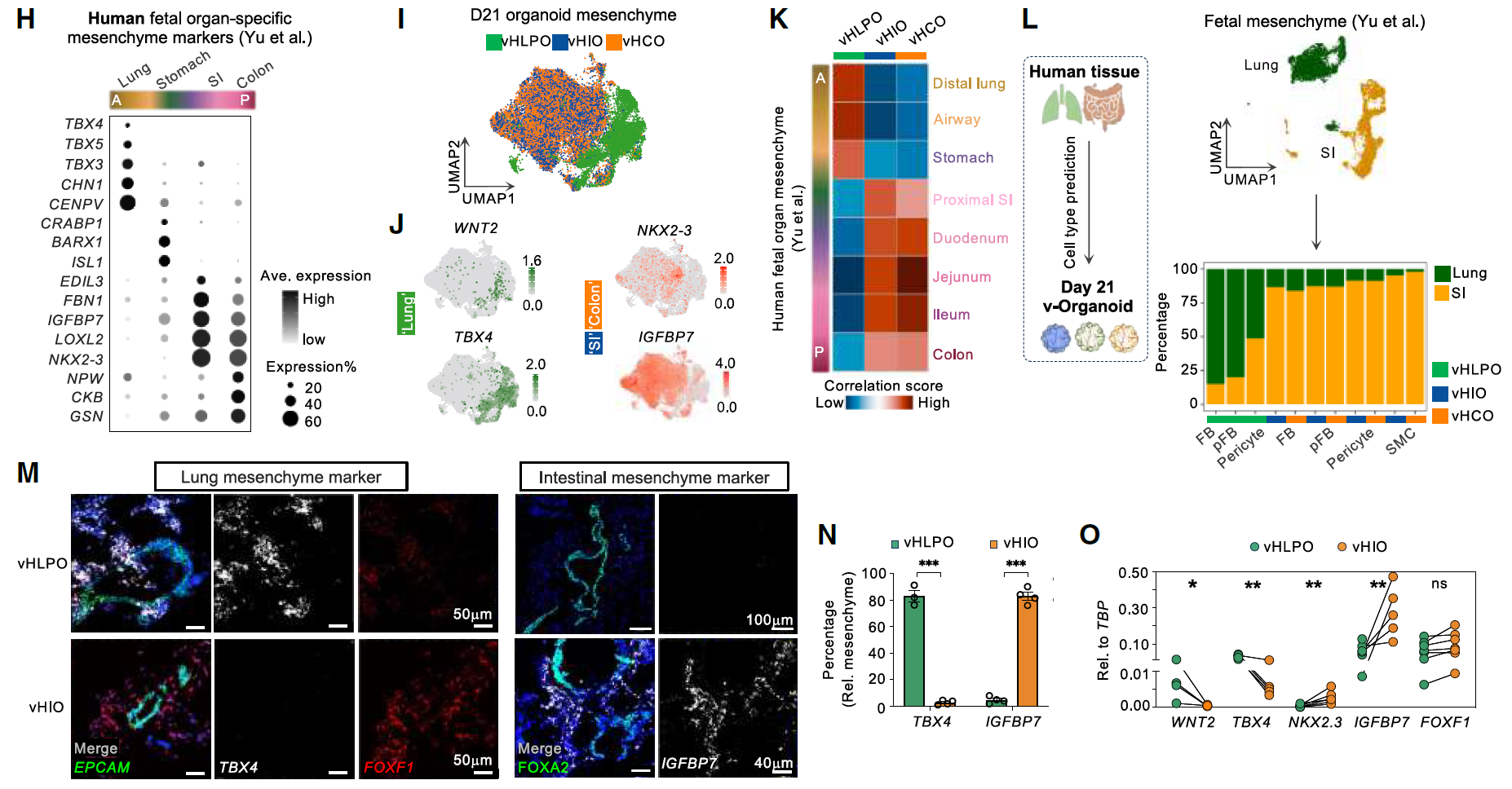
图3
4、血管化肺和肠类器官的体内成熟
为了促进成熟和灌注,血管化肠类器官被移植到免疫缺陷小鼠的肾包膜下,持续3个月。移植后,移植的血管化人类肺类器官(tvHLuO)发展出具有高肺上皮纯度的规则分支形态、广泛的血管化以及充满小鼠红细胞的可灌注的亚上皮毛细血管网。
通过物种特异性抗体和RNA探针发现大多数与类器官上皮相邻的血管起源于hPSC,而不是宿主。这一结论还通过追踪GFP-ESC生成的tvHLuO中宿主来源细胞得到了进一步支持(图4A-I)。
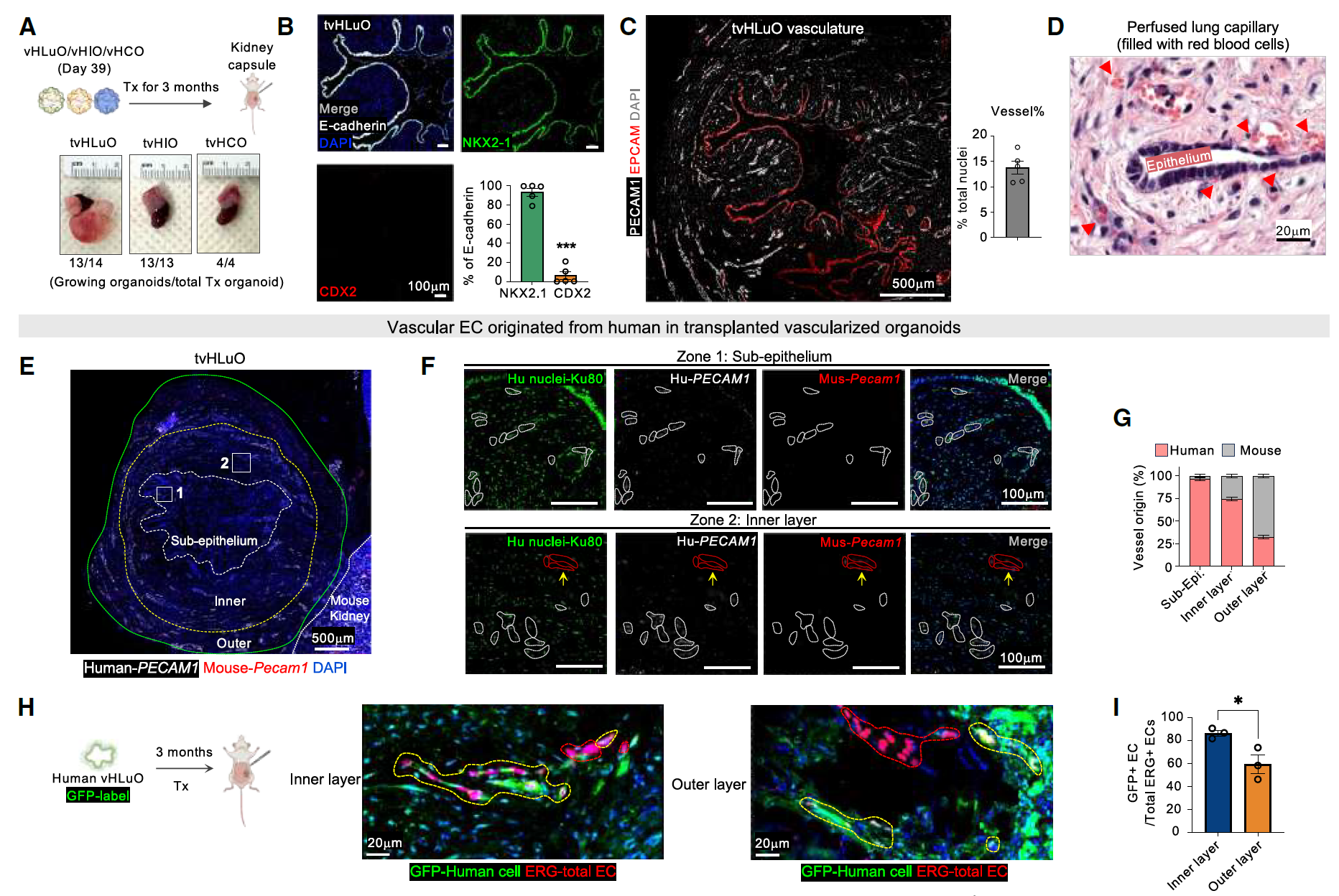
图4
同样,tvHIO和tvHCO也发展出具有大腔的规则肠结构、纯肠上皮身份、可灌注的亚上皮血管床以及在传统移植肠类器官(tHIO)和移植结肠类器官(tHCO)中缺失的广泛血管形成。
宿主来源的血管细胞对肠上皮相邻的血管床有贡献,同时还有多样化的肠上皮细胞类型(补充图S5E-J)。

补充图5
该研究还在tvHLuO中表征了最近发现的肺泡毛细血管EC亚型,即气细胞(aCap)和普通毛细血管内皮细胞(gCap)。smFISH显示,tvHLuO中存在类似aCap的细胞(FENDRR⁺)和类似gCap的细胞(IL-7R⁺/KIT⁺),而这些细胞在tvHIO中缺失(图4J)。
相反,肠内皮细胞标记物IGFBP7仅在tvHIO中表达,而在tvHLuO中未检测到。同样,器官特异性的间充质标记物在相应的移植类器官中持续表达。
为了进一步研究促进EC成熟和特异性分化的细胞间相互作用,分析了人类胎儿肺组织中靶向肺EC的配体-受体(L-R)对。通过smFISH在tvHLuO中确认了由周围间充质或EC分泌的关键L-R对,例如CXCL12-ACKR3和SEMA3E-PLXND1(图4K-L)。
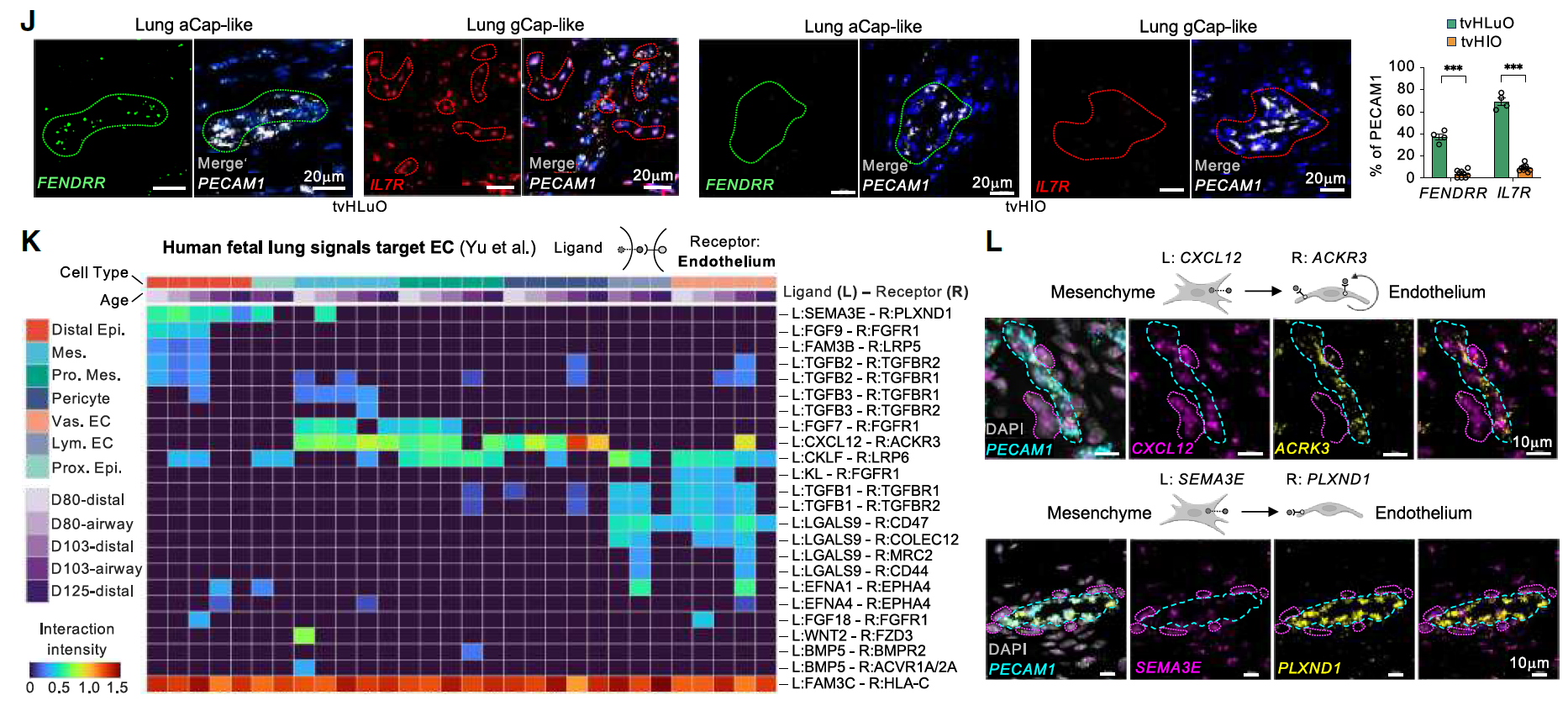
图4
5、改善vHLPO中的上皮成熟度和多样性
在邻近血管和间充质的支持下,第21天的vHLPO中的上皮细胞与传统肺祖细胞类器官(cLPO)相比,显示出与人类胎儿肺上皮在更晚发育阶段更高的相似性评分。同样地,与传统小肠类器官(cHIO)相比,vHIO中的小肠上皮也更为成熟。
血管化与传统肺类器官的上皮细胞的直接比较揭示了KRT19和CLDN4表达的降低。这些基因与肺泡前体1型过渡细胞状态(PATS)细胞相关,这些细胞在组织修复过程中表现出DNA损伤和衰老,并且在纤维化性肺病中富集。
通路富集分析显示,cLPO表现出与DNA损伤、凋亡和细胞死亡相关的通路激活,而与肺形态发生和发育相关的通路在vHLPO上皮中占主导地位。
与cLPO相比,在vHLPO中富集的基因,如SEMA3E和MECOM,已知在人类肺成熟过程中上调(图5A-D)。

图5
该研究还在tvHLuO中识别出了一种最近发现的人类呼吸性细支气管分泌细胞(RAS)类型,这种细胞类型表达SCGB3A2和SCGB1A1。这种独特的细胞类型位于呼吸性细支气管中,这一区域在小鼠中是缺失的。
对分泌液进行蛋白质组学分析确认,除了所有主要的肺分泌产物(包括表面活性蛋白和黏蛋白)外,还观察到了SCGB3A2、SCGB1A1和SFTPB肽的分泌。
为了揭示促进肺上皮发育和成熟的细胞间相互作用,在tvHLuO中绘制了空间信息,并将其与公开的人类胎儿肺图谱以及空间图谱进行了进一步比较。关键的L-R对(WNT5A-ANTXR1和FGF18-FGFR1),由周围的间充质或上皮细胞表达,并与tvHLuO中的上皮成熟相关(图5E-H)。

图5
6、生物工程支架上的肺泡结构形成
为了在体外重建具有相邻上皮、毛细血管内皮、间充质和细胞外基质的肺泡结构,将分离的vHLPO重新种植到气液界面(ALI)培养中,以诱导远端肺结构的形成。
分离的vHLPO细胞自主形成了类似肺泡囊的结构,而主要由iPSC衍生的II型肺泡上皮细胞(iAT2)组成的cLPO仅形成了单层结构。
进一步优化了之前报道的三维多孔明胶甲基丙烯酰(GelMA)肺支架,通过加入透明质酸甲基丙烯酰(HAMA)来促进上皮、间充质和血管EC的排列。
将分离的vHLPO种植到肺支架上后,EC沿着水凝胶囊表面排列并围绕肺上皮芽。当在支架上生长时,肺泡细胞类型以适当的肺泡几何结构出现,例如类似AT1和AT2的肺上皮以及类似aCap和gCap的肺内皮。
此外,生长在支架上的肺类器官细胞的超微结构显示出类似于胎儿肺中观察到的AT1和AT2细胞的形态:含有糖原但没有板层小体的立方细胞(双能祖细胞BPs)、含有糖原和板层小体的立方细胞(早期AT2细胞)以及部分扁平的细胞(早期AT1细胞)。
与整体成像结果一致,观察到早期AT1细胞与内皮细胞之间的物理邻接,这表明早期功能性屏障单元的形成已经开始(图6)。
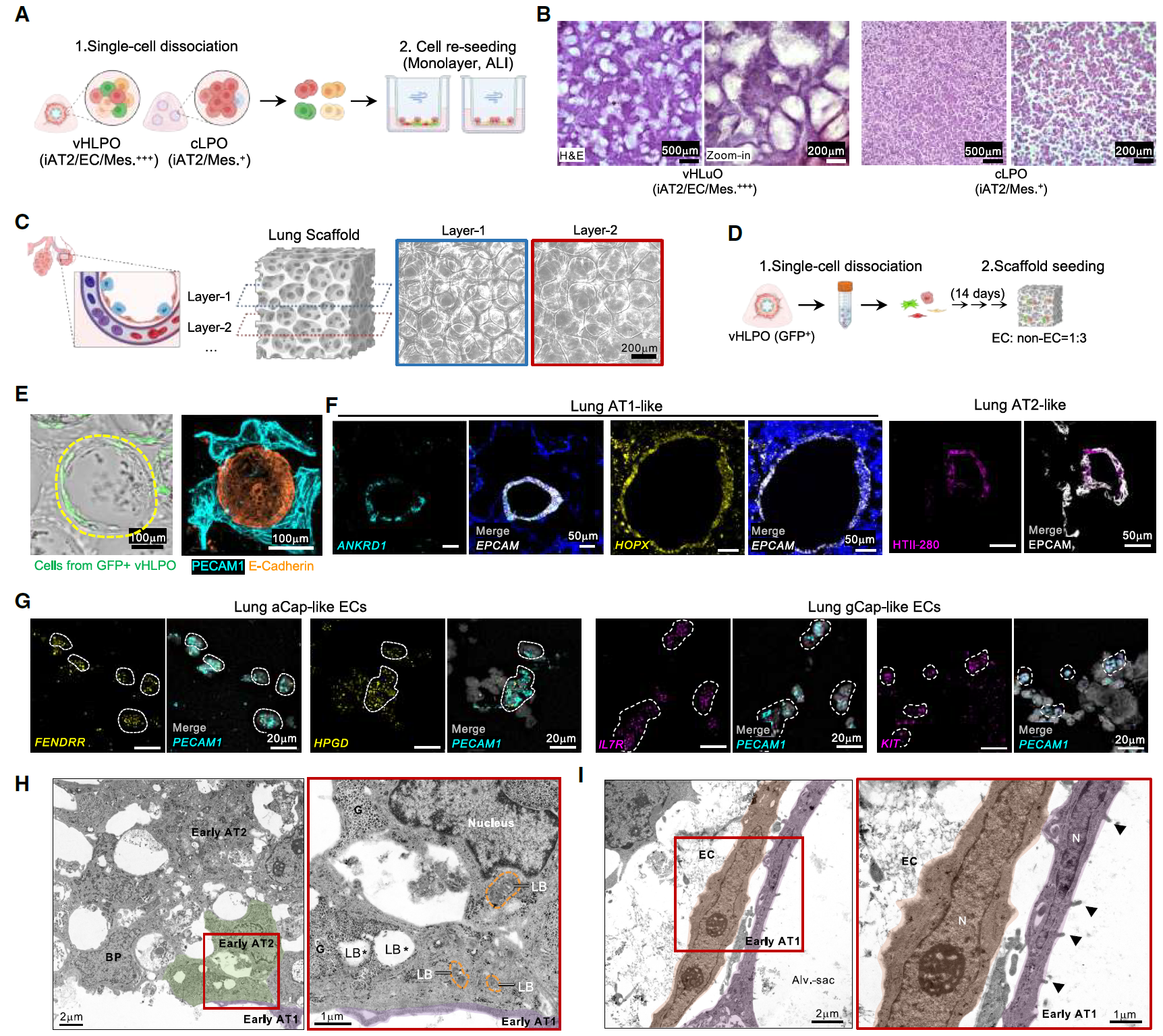
图6
7、基于FOXF1突变的先天性肺缺陷模型构建
传统肺类器官缺乏血管和间充质成分,限制了其在研究肺血管疾病中的应用。ACDMPV(肺泡毛细血管发育不良伴肺静脉错位)或ACD(肺动脉高压相关肺发育不良)是一种由FOXF1基因突变或缺失引起的致命先天性肺部疾病,目前尚无有效治疗方法。
从三名ACD患者的iPSC和三名健康对照组的iPSC中生成了vHLuO。其中一名患者(ACD-1,也称为“FOXF1.1”iPSC系)存在包含FOXF1基因位点的1.7Mb染色体缺失,另外两名患者则携带不同的FOXF1基因杂合突变(c.166C>G和c.253T>A,分别为ACD-2和ACD-3)。
ACD患者的vHLuO观察到毛细血管形成显著减少,aCap和gCap群体也有所减少。尽管肺上皮细胞中没有FOXF1表达,但观察到远端肺上皮细胞(SOX9⁺, NKX2-1⁺)数量减少,AT1细胞分化受损(HOPX⁺),以及损伤相关的AT1/AT2中间细胞(CLDN4⁺/NKX2.1⁺)积累。
值得注意的是,这些细胞表型与人类ACD肺组织中发现的非常相似(图7),并且由于缺乏FOXF1⁺间充质细胞和内皮细胞成分,这些表型无法在Foxf1突变小鼠模型或传统肺类器官中完全复制。
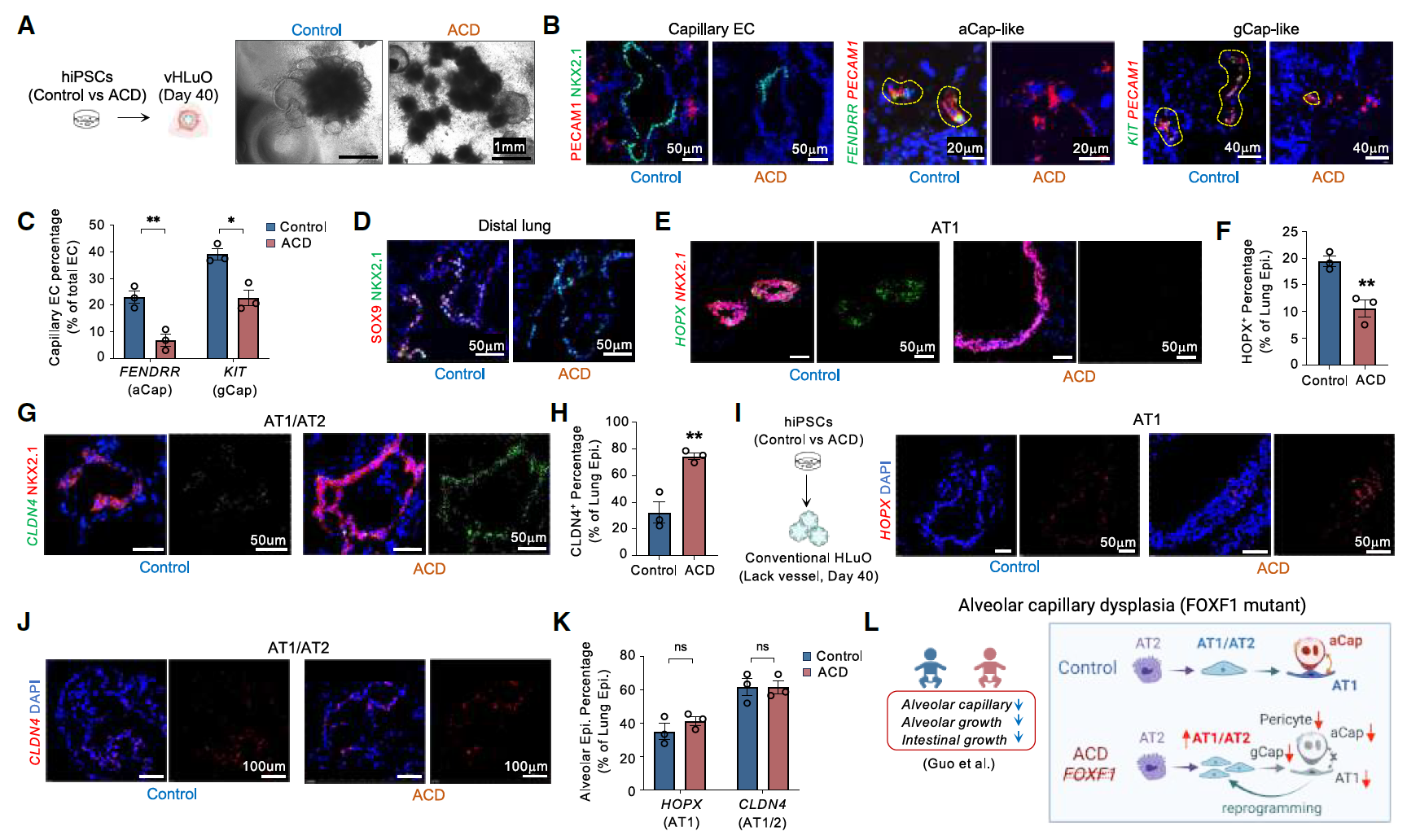
图7
小结
该研究重现了多个胚层的同时发育,促进了人类发育初期阶段的基本细胞间通信——这是组装体模型所缺乏的一个关键特征。
因此,与传统类器官模型相比,多谱系类器官中的上皮成熟度和器官特异性内皮细胞功能更接近于人类胎儿器官中发现的特征。
这些由iPSC衍生的类器官所具有的复杂三维结构和细胞多样性,为个性化再生治疗提供了一个充满希望的途径,尤其是对于那些存在血管缺陷的器官。这些血管网络还可以与微流控芯片系统整合,从而实现对免疫-内皮相互作用的动态研究。
此外,鉴于EC是移植排斥过程中的主要靶点,血管化的类器官为研究抗体介导的排斥反应中由EC介导的异种移植失败的机制提供了一个强大的模型。
参考文献
Miao Y, Pek NM, Tan C, Jiang C, Yu Z, Iwasawa K, Shi M, Kechele DO, Sundaram N, Pastrana-Gomez V, Sinner DI, Liu X, Lin KC, Na CL, Kishimoto K, Yang MC, Maharjan S, Tchieu J, Whitsett JA, Zhang YS, McCracken KW, Rottier RJ, Kotton DN, Helmrath MA, Wells JM, Takebe T, Zorn AM, Chen YW, Guo M, Gu M. Co-development of mesoderm and endoderm enables organotypic vascularization in lung and gut organoids. Cell. 2025 Jun 27:S0092-8674(25)00628-2. doi: 10.1016/j.cell.2025.05.041.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


