科学家揭示乙型肝炎病毒自限性新机制
来源:分子细胞卓越中心 2021-05-13 18:16
近期,Journal of Hepatology在线发表了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)研究员胡荣贵课题组的最新合作成果——Translatomic profiling reveals novel self-restricting virus-host interactions during HBV
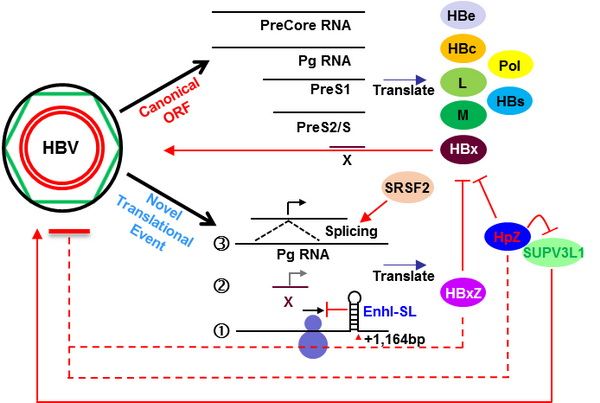
近期,Journal of Hepatology在线发表了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)研究员胡荣贵课题组的最新合作成果——Translatomic profiling reveals novel self-restricting virus-host interactions during HBV infection。该研究发现,乙型肝炎病毒(Hepatitis B virus, HBV)的P基因和X基因分别各自编码了一个同源异构体HpZ/P’和HBxZ,它们可以抑制HBV复制。此外,该研究还发现了一个定位在HBV增强子I区域的翻译调控元件。
乙型肝炎病毒感染是一个重要的全球性健康问题,是导致肝炎的主要原因之一。目前,世界上乙型肝炎病毒的慢性感染病例数较多,儿童时期垂直感染的病例是HBV感染人类的主要途径,感染了乙型肝炎病毒的患者中会有一定比例的人数在成年后发展成肝纤维化或肝癌。一般来说,大多数成年时期感染HBV后基本上没有明显症状,最后机体会清除掉体内的HBV,提示在成年人中的HBV感染是自限性的,而其机制未知。
该研究使用转录组测序技术(RNA-sequencing)结合核糖体图谱技术(ribosome profiling),结合定量蛋白组学,系统分析了HBV和宿主的相互作用。通过研究一个最近开发出来的1.0倍HBV重组cccDNA系统,研究人员发现了一个定位在HBV基因组增强子I区域的翻译调控元件EnhI-SL(stem loop within enhancer I)。细胞研究表明,突变破坏其茎环结构可增强报告基因或HBV聚合酶表达,但对其转录无明显影响。此外,核糖体图谱分析结合定量质谱及突变研究发现并证实,HBV的P基因和X基因会分别编码一个截短体,命名为HpZ/P’和HBxZ。其中,HpZ/P’的产生依赖于HBV前基因组RNA的两个特定位点的剪接,且这种剪接方式是HBV前基因组RNA所有剪接方式里丰度最高且最保守的;HBxZ的翻译依赖于核糖体识别HBx转录本内部保守的起始密码子。分别过表达这两个基因可显着抑制HBV的三个主要抗原(HBc、HBs及HBe)的表达,过表达HCV的聚合酶或一个不相关的宿主基因MAP2K2则没有抑制作用。同时,southern blot分析和动物实验显示,HpZ/P’可抑制HBV基因组的复制和转录。使用二代测序和三代测序对处于免疫耐受期或免疫激活期的慢性乙肝患者的血清进行HBV准种分析发现,特异性删除HpZ/P’,但不影响HBV前基因组RNA剪接的突变体A2446G,以及破坏EnhI-SL元件的突变体G1164A在免疫耐受期的病人的准种里占有的比例明显高于免疫激活期,提示这两个突变可能经历了宿主免疫系统的负向筛选。
机制上,研究人员发现宿主蛋白SUPV3L1能够促进HBV基因表达,提示它可能是HBV挟持的一个宿主因子,HpZ/P’可与宿主的SUPV3L1蛋白相互作用并抑制SUPV3L1对HBV基因表达的促进作用。此外,研究还发现,HpZ/P’可与HBx相互作用并影响HBV重组cccDNA的表观遗传修饰。最后,研究人员发现SRSF2——一种宿主RNA剪接体的组成成分,在HBV复制期间被下调;过表达SRSF2可促进病毒前基因组RNA剪接依赖的HpZ/P’产生。
综上,该研究从多组学整合分析出发,揭示了乙肝病毒与宿主的相互作用中的多种自限性机制。针对这些机制的发现一方面有助于理解HBV感染相关的生物学过程,也为发展全新的靶向干预策略奠定了基础。其中,SRSF2-HpZ/P’轴似乎构成乙肝病毒生活周期中的另一种负反馈调节环路。因此,靶向宿主剪接体可能代表干预乙肝病毒-宿主相互作用的新策略。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


