Nat Immunol:缪小平/田剑波团队绘制肿瘤微环境中免疫细胞遗传调控图谱并揭示其作用模式及早筛应用价值
来源:生物探索 2024-09-11 10:52
这项研究明确了机体胚系遗传变异在肿瘤微环境异质性中的作用,提供了最全面的肿瘤免疫浸润遗传调控图谱,揭示了胚系变异可能通过调控免疫反应在肿瘤发生和进程中发挥着关键作用。
武汉大学公共卫生学院和泰康生命医学中心缪小平/田剑波教授团队,在Nature Immunology在线发表了题为 An atlas of genetic effects on cellular composition of the tumor microenvironment 的研究论文,绘制了肿瘤微环境中免疫细胞遗传调控图谱并揭示其作用模式及早筛应用价值。

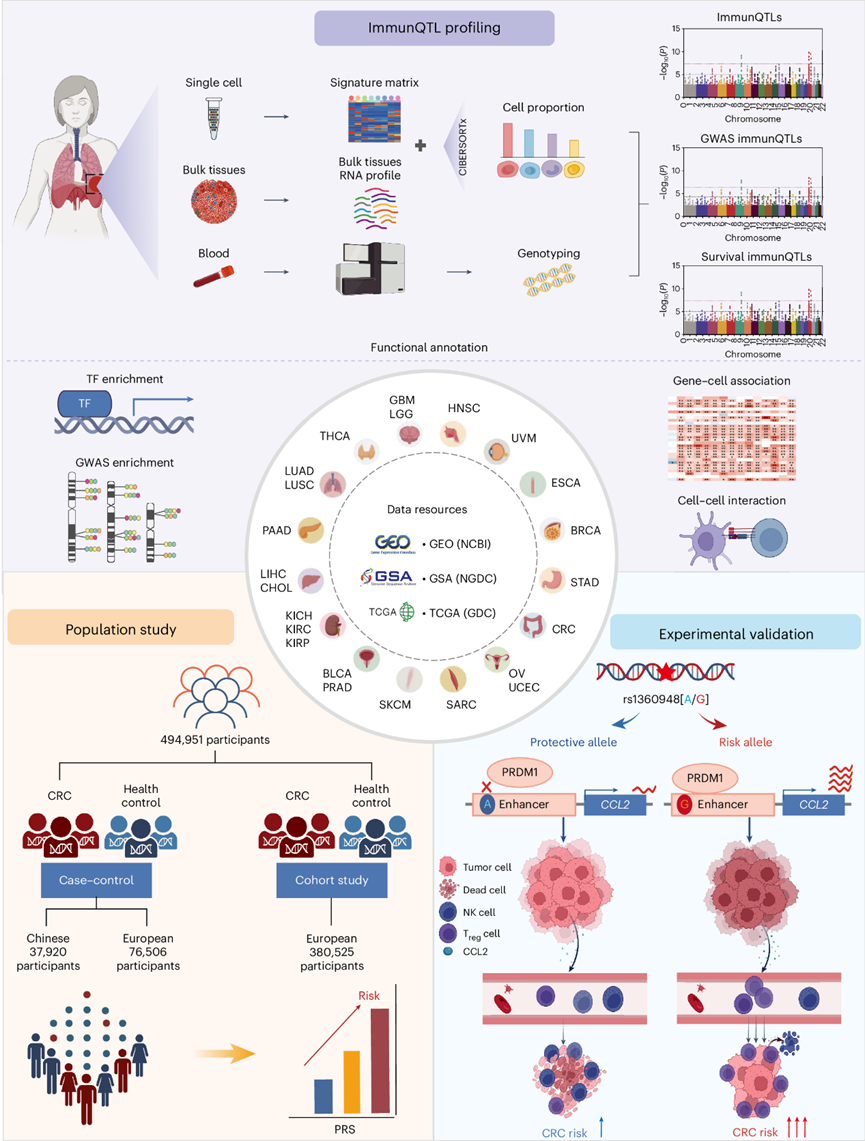
研究者利用单细胞RNA测序(single-cell RNA sequencing,scRNA-seq)数据构建细胞特异性表达矩阵,基于机器学习算法量化了囊括23种肿瘤类型中共54种细胞的相对含量。结合这7707例样本的全基因组遗传数据,共鉴定出3494个immunQTLs。进一步的功能注释揭示,immunQTLs可能通过调控免疫浸润相关基因表达影响TME细胞组成,进而影响肿瘤系列表型并解释肿瘤易感的遗传归因。此外,研究者还揭示immunQTLs的靶基因密切参与机体免疫以及肿瘤相关的多个生物学过程,并与多种免疫药物反应相关,为未来临床药物靶标的筛选提供了数据参考。
研究者进一步利用团队前期154例结直肠癌正常、肿瘤组织的转录组和基因组等多维度组学数据,并整合单细胞组作为参考数据,绘制了中国人群结直肠癌免疫浸润遗传调控图谱,共鉴定到568个immunQTLs,这些位点在结直肠癌的易感区域显著富集,并在癌症基因组图谱TCGA中较好验证。非常有意义的是,研究者整合immunQTLs以及结直肠癌GWAS位点构建的多基因风险评分模型(Polygenetic risk score, PRS) 能有效地提高结直肠癌风险分层效能和高危人群识别能力。利用团队前期构建的全国多中心中国人群结直肠癌的病例-对照样本中(21874例),发现相比低遗传风险的个体,同样的环境暴露下,携带高遗传风险评分的个体罹患结直肠癌的风险增加1.95倍。难能可贵的是,该模型在欧洲和美洲多个独立结直肠癌人群中得到很好的验证。
另外,研究者进一步将该模型应用在大规模的自然人群队列中,发现该模型对新发结直肠癌也具备较好的预测效能和高危人群分层能力。在多个独立、大规模、多维度的人群队列样本中,层次递进的验证表明了模型风险预测的稳健性和可靠性,表明免疫浸润相关遗传位点不仅有助于剖析肿瘤免疫调控新机制,还有望应用于肿瘤高危人群识别和早筛方案的制定。
最后,利用团队前期在人群样本积累和功能解读优势,研究者对免疫调控效能最强的遗传变异位点CCL2-rs1360948进行多种族、多中心的人群流行病学研究(76506例欧洲人群和37920例中国人群),发现rs1360948-G显著增加结直肠癌的风险,并缩短患者预后生存期。进一步的机制实验发现,该变异能够提高其所在增强子区域与转录因子PRDM1的结合能力,通过染色质三维折叠远程促进目标效应基因CCL2的表达,后者招募更多的Treg细胞浸润来发挥免疫抑制作用,进而促进肿瘤细胞的免疫逃逸,最终导致结直肠癌风险增加和预后不良。另外,研究者还进一步发现靶向CCL2-CCR2信号轴能够增强PD-L1抗体治疗效果,并在免疫动物模型中发现CCL2-CCR2单抗和PD-L1单抗具备较好的联合抗肿瘤效果,为结直肠癌患者精准防治提供了潜在的联合治疗策略,尤其是发生遗传变异的个体。
这项研究明确了机体胚系遗传变异在肿瘤微环境异质性中的作用,提供了最全面的肿瘤免疫浸润遗传调控图谱,揭示了胚系变异可能通过调控免疫反应在肿瘤发生和进程中发挥着关键作用,为解析肿瘤免疫的遗传精细调控提供了新的线索。同时,此项研究受编辑邀请撰写 “Genomic map of cellular composition of the tumor microenvironment”的Research Briefing,进一步概述了研究的关键发现及其在肿瘤免疫领域的意义和价值。
模式图(Credit: Nature Immunology)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


