Cell Res:王皞鹏/吴海涛/许琛琦/宋献民合作开发CAR-T理性设计平台
来源:iNature 2023-04-10 10:52
该研究阐明了CAR-T细胞中基底信号形成的机制,开发了基于基底信号调控的CAR理性设计(rational design)平台,为推进CAR-T细胞治疗实体瘤提供了新策略。
嵌合抗原受体(CAR)的强化信号,即CAR在没有肿瘤抗原刺激的情况下自发激活,被认为是控制CAR-T疗效的关键事件。然而,自发CAR信号背后的分子机制仍然难以捉摸。
上海科技大学生命科学与技术学院王皞鹏课题组联合复旦大学附属眼耳鼻喉科医院吴海涛团队、中科院分子细胞科学卓越创新中心许琛琦实验室,以及上海市第一人民医院宋献民课题组在Cell Research 上发表了题为 “Tuning charge density of chimeric antigen receptor optimizes tonic signaling and CAR-T cell fitness”的研究论文,并被杂志列为精选论文(Featured Article)。该研究阐明了CAR-T细胞中基底信号形成的机制,开发了基于基底信号调控的CAR理性设计(rational design)平台,为推进CAR-T细胞治疗实体瘤提供了新策略。

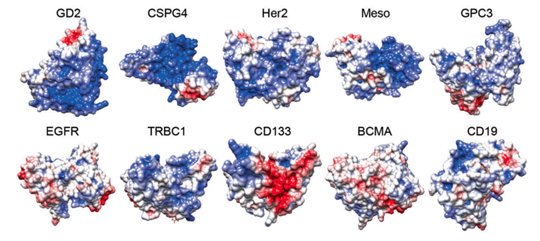
图一:CAR受体表面电荷的分布(临床中常见的10种CAR的设计。其中蓝色:正电荷基团;红色:负电荷基团)
在该项研究中,研究人员首次揭示了CAR受体表面正电荷斑块(PCP)介导的静电作用是基底信号的重要发生机制(图一)。研究人员发现,大多数靶向实体瘤的CAR-T细胞往往会因为基底信号强度过高导致自发耗竭,如GD2、CSPG4 CAR等,可以通过提高盐离子浓度或者缩小PCP的方法来减弱实体瘤CAR-T细胞的基底信号,提高它们的体内生存优势。然而,某些治疗血液肿瘤的CAR-T细胞会因为基底信号强度不足导致持续能力不够,如CD19、CD22 CAR等,设计者又可以通过增大PCP的方法来增强该类CAR-T细胞的基底信号,增强它们的体内持续能力。
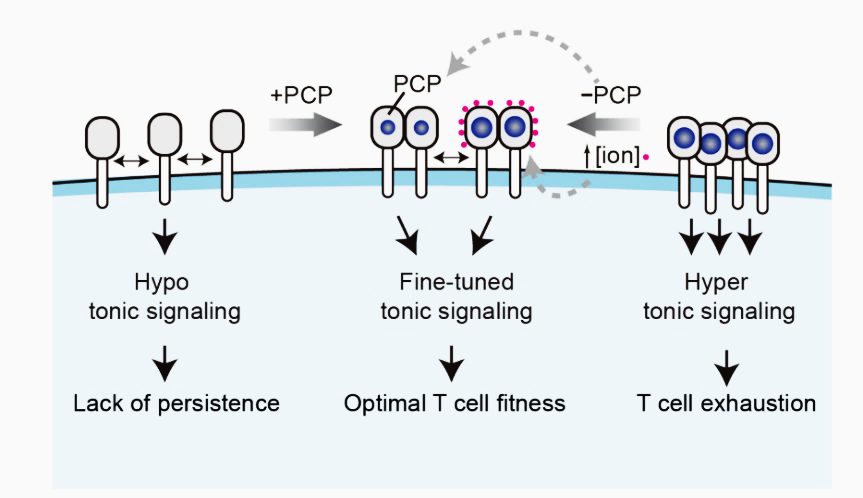
图二. CAR-T基底信号的产生机制与调控方法(基底信号过弱导致体内持续性不足,可以通过增加PCP的方法提高基底信号强度进而改善其活力;基底信号过强导致T细胞耗竭,可以通过缩小PCP或增加盐离子浓度的方式减弱基底信号进而促进其活性;PCP,正电荷斑块;ion,盐离子)
研究人员提出的理性设计概念能为CAR的结构设计提供评价指导和功能预测,大大加速CAR-T的研发效率和进程,进而推动肿瘤尤其是实体瘤CAR-T治疗研究领域的发展进步(图二)。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


