2023年诺贝尔生理学或医学奖,为何是mRNA技术,为何授予他们二人?
来源:生物世界 2023-10-05 19:00
通过他们对mRNA碱基修饰的重要性的基础发现,Katalin Karikó 和 Drew Weissman 在我们这个时代最大的健康危机之一中为这一变革性发展做出了关键贡献。
2023年10月2日,诺贝尔奖生理学或医学奖授予了mRNA技术的两位奠基人——Katalin Karikó、Drew Weissman。
获奖理由是:他们发现了核苷碱基修饰,从而开发出了有效的mRNA疫苗来对抗COVID-19。他们二人的发现对于在2020年初开始的大流行期间开发有效的mRNA疫苗来对抗COVID-19至关重要。他们的开创性发现,从根本上改变了我们对mRNA如何与免疫系统相互作用的理解,他们在现代人类健康面临最大威胁之一的时期,为前所未有的疫苗开发速度做出了贡献。
新冠大流行之前的疫苗
接种疫苗可以刺激对特定病原体的免疫反应,这使得我们的身体在以后接触到该病原体时能够提前开始对抗疾病。基于灭活病毒或减毒病毒的疫苗已经存在很长时间了,例如针对脊髓灰质炎、麻疹和黄热病的疫苗。1951年,Max Theiler因开发黄热病疫苗而获得了诺贝尔生理学或医学奖。
由于近几十年来分子生物学领域的进展,已经开发出基于病毒的单一成分而非整个病毒的疫苗。病毒遗传密码的部分内容,通常编码病毒表面的蛋白质,用于制造刺激形成病毒阻断抗体的蛋白质。例如,针对乙肝病毒(HBV)和人类乳头瘤病毒(HPV)的疫苗。或者,病毒遗传密码的部分内容可以转移到无害病毒“载体”上,例如用这种方法开发的埃博拉病毒疫苗。
当注射这些载体疫苗时,选定的病毒蛋白质在我们的细胞中产生,刺激针对目标病毒的免疫反应。生产基于整个病毒、蛋白质和载体的疫苗需要大规模细胞培养。这种资源密集型过程限制了应对疫情和大流行快速生产疫苗的可能性。因此,研究人员长期以来一直试图开发无需依赖细胞培养的疫苗技术,但事实证明这非常具有挑战性。
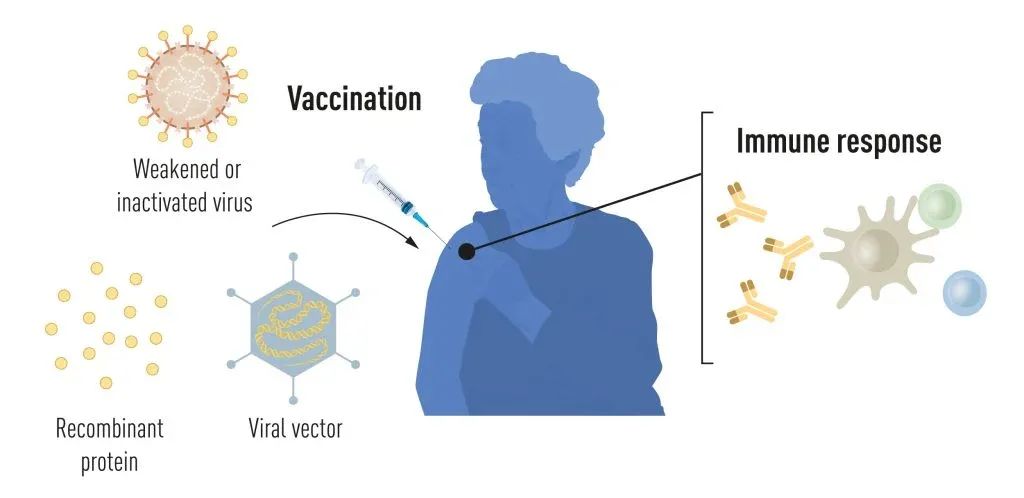
新冠大流行之前的疫苗生产方法
mRNA疫苗:一个有前途的想法
在我们的细胞中,DNA编码的遗传信息会先转录到mRNA,然后再被翻译蛋白质,进而执行生命活动。20世纪80年代,引入了无需细胞培养即可产生mRNA的有效方法——体外转录。这一决定性步骤加速了分子生物学在多个领域中的应用发展。
将mRNA技术用于疫苗和治疗目的的想法也开始起飞,但前方仍存在障碍。体外转录得到的mRNA并不稳定,其递送具有挑战性,需要开发复杂的载体脂质系统来封装mRNA。此外,体外产生的mRNA会引起炎症反应。因此,最初人们对开发临床用途的mRNA技术的兴趣寥寥。
但这些障碍并没有阻止一位出生于匈牙利的生物化学家——Katalin Karikó,她致力于开发使用mRNA进行治疗的方法。
20世纪90年代初,当她还是宾夕法尼亚大学的助理教授时,她正在坚持实现mRNA作为一种治疗手段的愿景,但却一直没能获得科研资助。后来,她遇到了宾夕法尼亚大学的免疫学家 Drew Weissman。那时的他对树突状细胞感兴趣,树突状细胞在免疫监测和疫苗诱导的免疫反应激活方面发挥至关重要的作用。
在新思想的刺激下,两人很快开始了富有成效的合作,重点是不同类型的RNA如何与免疫系统相互作用。

Drew Weissman(左)、Katalin Karikó(右)
获得突破
Karikó和Weissman注意到树突状细胞将体外转录的mRNA识别为外来物质,导致其活化并释放炎症信号分子。他们想知道为什么体外转录的mRNA被识别为外来物质,而来自哺乳动物细胞的mRNA却没有引起同样的反应。
很快,他们意识到,一些关键性质必须区分不同类型的mRNA。
RNA含有四个碱基,缩写为A、U、G和C,对应于DNA中的A、T、G和C。Karikó和Weissman知道,来自哺乳动物细胞的RNA中的碱基经常被化学修饰,而体外转录的mRNA则没有被修饰。他们想知道,体外转录的mRNA中没有改变的碱基是否可以解释不必要的炎症反应。为了验证这一点,他们产生了不同的mRNA变体,每个变体的碱基都有独特的化学修饰,然后将其递送给树突状细胞。
结果令人震惊:当使用碱基修饰过的mRNA时,炎症反应几乎被消除了。
这是我们对细胞如何识别和响应不同形式的mRNA的理解的一个范式变化。Karikó和Weissman立即意识到,他们的发现对将mRNA用于治疗具有深远的意义。
2005年,他们在 Cell 子刊 Immunity 上发表了这项具有里程碑意义的研究论文【1】。这比新冠大流行早了15年。

这篇 Immunity 论文共四位作者——Katalin Karikó、Drew Weissman、Michael Buckstein 和 倪厚萍,前两人获得了今年的诺贝尔奖, Michael Buckstein 现为西奈山伊坎医学院肿瘤放射学副教授,倪厚萍自1998年至今为Drew Weissman实验室主管,她于1984年本科毕业于衡阳医学院(现为南华大学衡阳医学院),并于2006年获得维拉诺瓦大学应用统计学硕士学位。她除了管理实验室外,还在实验室为多项mRNA疫苗项目进行质控测试。

Michael Buckstein(左)、倪厚萍(右)
2008年,Karikó 和 Weissman 在 Molecular Therapy 期刊发表论文【2】,发现了与未经修饰的mRNA相比,假尿嘧啶碱基修饰的mRNA的递送显著增加了蛋白质产量。

2010年,他们在 Nucleic Acids Research 期刊发表论文【3】,进一步发现假尿嘧啶碱基修饰的mRNA会减少对RNA依赖性蛋白激酶的激活,从而增强mRNA的翻译,增加蛋白质产量。
这些研究表明,碱基修饰既能减少mRNA带来的炎症反应,又能增加蛋白质的产生,从而消除了mRNA临床应用道路上的关键障碍。
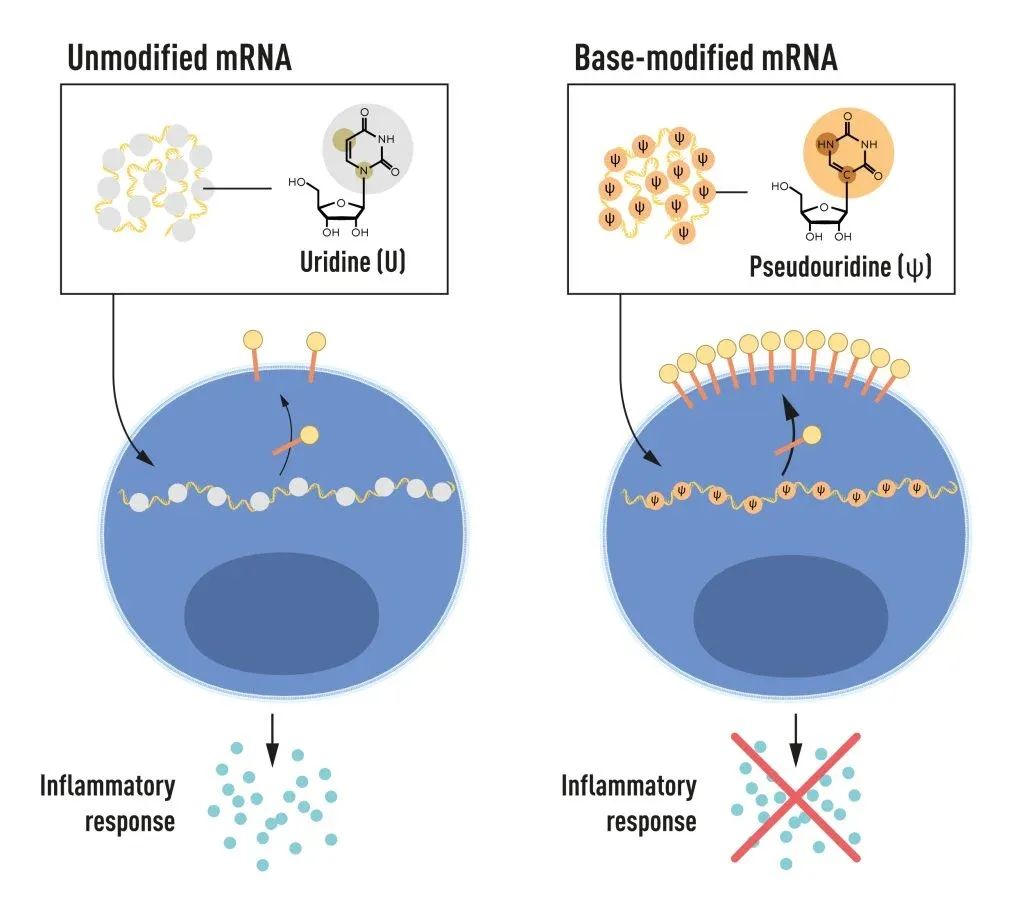
碱基修饰的mRNA可以用来阻止炎症反应的激活,还能在mRN递送进细胞时增加蛋白质的产生
mRNA疫苗发挥了它们的潜力
在他们做出的关键突破后,人们对mRNA技术的兴趣开始增加,2010年,又几家公司开始尝试开发基于mRNA的疫苗,例如针对寨卡病毒和中东呼吸综合征冠状病毒的实验性疫苗。
COVID-19大流行爆发后,两款编码SARS-CoV-2刺突蛋白的经过碱基修饰的mRNA疫苗以创纪录的速度被开发出来,其保护效果高达95%,这两款mRNA于2020年12月获得FDA批准上市,并在全世界范围内得到广泛使用。
mRNA疫苗开发的令人印象深刻的灵活性和速度为使用这个新平台开发针对其他传染病的疫苗铺平了道路。这些疫苗挽救了数百万人的生命,并预防了更多新冠感染者发展为严重疾病,使社会得以开放并恢复正常状态。未来,mRNA技术还可能用于递送治疗性蛋白质和治疗某些癌症。
通过他们对mRNA碱基修饰的重要性的基础发现,Katalin Karikó 和 Drew Weissman 在我们这个时代最大的健康危机之一中为这一变革性发展做出了关键贡献。
核心研究论文
Karikó, K., Buckstein, M., Ni, H. and Weissman, D. Suppression of RNA Recognition by Toll-like Receptors: The impact of nucleoside modification and the evolutionary origin of RNA. Immunity 23, 165–175 (2005).
Karikó, K., Muramatsu, H., Welsh, F.A., Ludwig, J., Kato, H., Akira, S. and Weissman, D. Incorporation of pseudouridine into mRNA yields superior nonimmunogenic vector with increased translational capacity and biological stability. Mol Ther 16, 1833–1840 (2008).
Anderson, B.R., Muramatsu, H., Nallagatla, S.R., Bevilacqua, P.C., Sansing, L.H., Weissman, D. and Karikó, K. Incorporation of pseudouridine into mRNA enhances translation by diminishing PKR activation. Nucleic Acids Res. 38, 5884–5892 (2010).
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


