Nat Cancer | 叶丽林/张国中/白凡/李颜发现增强癌症免疫治疗的新策略
来源:生物探索 2024-04-17 11:11
该研究发现OV-BYTE疗法将功能性TBYS细胞的细胞毒性重定向到肿瘤细胞,以改善肿瘤控制,并与PD-L1 ICB具有协同作用。
陆军军医大学叶丽林、中国农业大学张国中、北京大学白凡及南京大学李颜共同通讯在Nature Cancer 在线发表题为“An oncolytic virus delivering tumor-irrelevant bystander T cell epitopes induces anti-tumor immunity and potentiates cancer immunotherapy”的研究论文,该研究设计了编码TBYS表位(OV- byte)的溶瘤病毒(OV),将肿瘤细胞的抗原特异性转移到预先存在的TBYS细胞上,从而在多个临床前模型中实现了有效的肿瘤抑制。
在机制上,OV-BYTE诱导肿瘤抗原的表位扩散,以引发更多样化的肿瘤特异性T细胞反应。值得注意的是,针对人类严重急性呼吸综合征冠状病毒2 (SARS-CoV-2)特异性T细胞记忆的OV-BYTE策略在人类肿瘤细胞来源的异种移植模型中有效抑制了肿瘤进展,为改善具有SARS-CoV-2感染史或冠状病毒病2019 (COVID-19)疫苗接种史的大量人群的癌症免疫治疗提供了重要见解。

在急性感染或接种疫苗后,记忆T (TMEM)细胞形成并提供长期保护以抵抗同源病原体。相比之下,T细胞的功能衰竭在许多慢性感染和癌症中已经得到了很好的表征。特异性识别肿瘤抗原的肿瘤浸润性CD8+ T细胞表现出典型的衰竭相关表型,包括效应功能、增殖能力和记忆潜力的逐渐丧失,同时具有一组抑制性免疫检查点受体(例如PD-1、CTLA-4和TIM-3)的升高和持续表达。
针对这些抑制性免疫检查点受体的阻断抗体,称为免疫检查点阻断(ICB),可以使TME中耗尽的CD8+ T (TEX)细胞重新焕发活力,从而使TME中的CD8+ T (TEX)细胞恢复活力,为ICB临床疗效奠定基础。尽管针对PD-1程序性细胞死亡配体1 (PD-L1)相互作用的ICB疗法在一部分癌症患者中有持久的缓解,但在某些癌症类型中,总体缓解率仍然适度,甚至是惰性的,这可能部分解释为ICB疗法并没有从根本上改变TEX细胞中耗尽遗传的表观遗传程序,也没有重新编程这些细胞分化为TMEM细胞。
越来越多的证据表明,肿瘤衍生抗原的特异性识别仅限于一小部分肿瘤浸润T细胞,而绝大多数肿瘤浸润T细胞识别肿瘤无关抗原,特别是常见的病毒抗原,因此被定义为“TBYS细胞”。据报道,肿瘤浸润的TBYS细胞表现出tmem相关表型;然而,它们的详细分化状态并没有很好地表征。特别是,CD8+ TBYS细胞和CD4+细胞在TME中是否具有相似的记忆特征尚不清楚。此外,由于TME中TBYS细胞的数量和功能远远超过肿瘤特异性的TEX细胞,如果原位TBYS细胞能够被重新利用来消除肿瘤细胞,将具有很大的治疗价值。
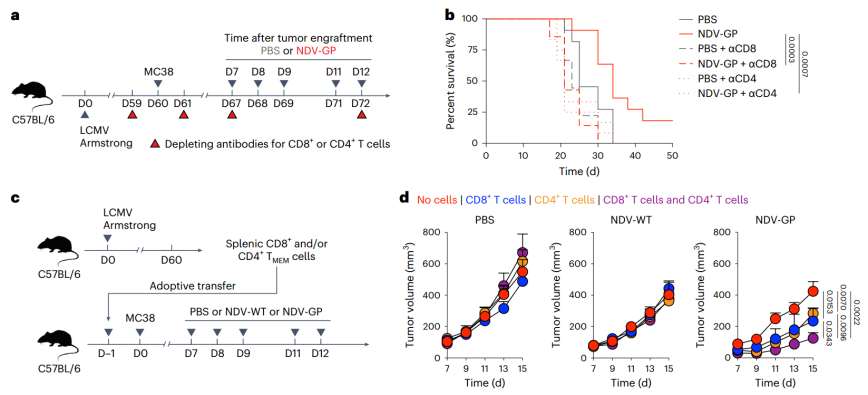
OV-BYTE治疗的抗肿瘤作用归因于病毒特异性CD8+和CD4+ TBYS细胞(Credit: Nature Cancer)
OV是一种高度通用的平台,可以将各种有效载荷送入肿瘤细胞。许多具有强致瘤性的DNA或RNA病毒已被提出作为OV免疫治疗的载体,如单纯疱疹病毒(HSV)、腺病毒和新城疫病毒(NDV)。到目前为止,OV免疫疗法已经在大约100个临床试验中进行了研究,其中编码粒细胞-巨噬细胞集落刺激因子(称为T-VEC)的改良HSV已被FDA批准,另一种三突变HSV(称为G47Δ)已被批准用于治疗复发性胶质母细胞瘤。
目前尚不清楚OV是否可以被利用来驱动肿瘤细胞呈递TBYS细胞特异性抗原,从而导致肿瘤细胞被TME中具有功能记忆特性的TBYS细胞根除。总之,该研究发现OV-BYTE疗法将功能性TBYS细胞的细胞毒性重定向到肿瘤细胞,以改善肿瘤控制,并与PD-L1 ICB具有协同作用。因此,OV-BYTE与PD-1和/或PD-L1 ICB的联合可能会扩大癌症免疫治疗的工具包。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


