盘点:2022年细胞疗法进展及其展望
来源:生物谷原创 2022-12-27 13:23
细胞疗法是指将正常的或生物工程改造过的人体细胞移植或输入患者体内,新输入的细胞可以替代受损细胞、或者具有更强的免疫杀伤功能,从而达到治疗疾病的目的。
细胞疗法是指将正常的或生物工程改造过的人体细胞移植或输入患者体内,新输入的细胞可以替代受损细胞、或者具有更强的免疫杀伤功能,从而达到治疗疾病的目的。通常而言,细胞疗法主要包括肿瘤细胞免疫疗法和干细胞疗法两大类。细胞疗法在治疗癌症、血液病、心血管病、糖尿病、老年痴呆症等方面前景广阔。
来自健康供者免疫系统的人T细胞的扫描电镜图,图片来自NIAID。
肿瘤细胞免疫疗法是指获取来自患者体内的免疫细胞,然后进行体外培养和扩增,再回输到病人体内,来激发以及增强机体的自身免疫功能以治疗肿瘤,主要包括过继细胞免疫疗法、肿瘤疫苗、非特异性免疫刺激和免疫检查点阻断疗法,其中过继细胞免疫疗法包括肿瘤浸润淋巴细胞(TIL)疗法、TCR-T细胞疗法、CAR-T细胞疗法、淋巴因子活化杀伤细胞(LAK)疗法、细胞因子诱导杀伤细胞(CIK)疗法、树突细胞疗法和自然杀伤细胞(NK)疗法。干细胞疗法是利用干细胞的自我更新能力和分化潜能,用于治疗血液系统疾病、神经系统疾病、心血管疾病、肝脏疾病和内分泌疾病等疾病。
在2022年,科学家们在细胞疗法领域取得重大的进展,让我们一起看看这个领域在这一年里取得的重要进展。
1. Science:靶向中介体复合物激酶模块可增强CAR-T细胞的抗肿瘤效力
T细胞免疫疗法对某些癌症显示出令人印象深刻的疗效,但大多数患者并没有获得持久的反应。这类免疫疗法取得进展的核心障碍是T细胞效力不足,无法根除巨大的肿瘤负担,这是由多种因素造成的,包括T细胞衰竭、衰老、无能(anergy)和免疫抑制。基因编辑有潜力提高癌症免疫疗法的疗效,但目前仍不清楚哪些基因或哪组基因在编辑后能最有效地提高T细胞的效力。
在一项新的研究中,来自美国斯坦福大学的研究人员在人类嵌合抗原受体(CAR)T细胞(CAR-T)中进行了两次CRISPR筛选,使用的模型系统通过模拟慢性抗原暴露来诱导T细胞功能障碍 (Katherine A. Freitas et al. Enhanced T cell effector activity by targeting the Mediator kinase module, Science, 2022, doi:10.1126/science.abn5647)。基于较高的增殖率和细胞因子产生率是最有效的抗肿瘤T细胞的特征这一假设,他们确定了在肿瘤暴露后增殖并产生白细胞介素-2(IL-2)和肿瘤坏死因子-α(TNFα)的T细胞中富含的向导RNA(gRNA)。
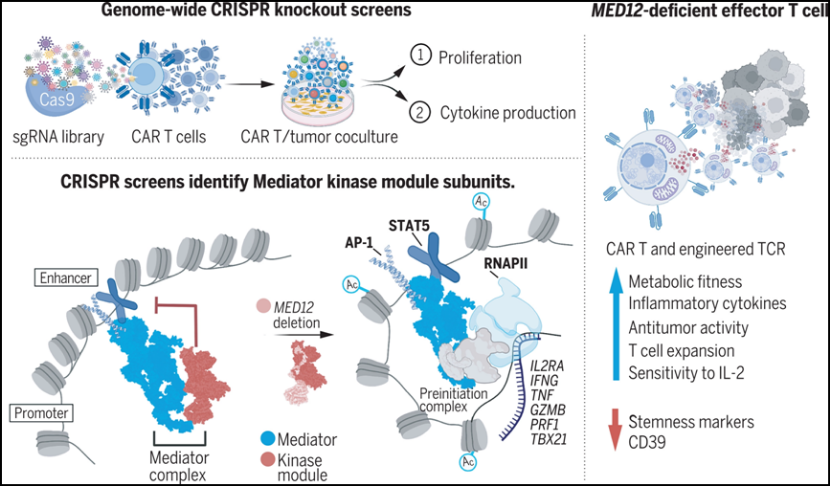
在人类T细胞中,破坏中介体复合物激酶模块会在转录上重新连接效应编程。图片来自Science, 2022, doi:10.1126/science.abn5647。
两次CRISPR筛选都发现了编码中介体复合物(Mediator complex)亚基的基因,这些基因包含在中介体复合物激酶模块中。中介体复合物作为增强子结合的转录因子和通用转录复合物(transcription machinery)之间的桥梁,通过协调转录网络在建立细胞身份方面起着核心作用。在人类CAR-T细胞中靶向剔除MED12(中介体复合物亚基12)或CCNC(细胞周期蛋白C)可导致增殖、细胞因子产生和肿瘤清除率增加。对于靶向多种肿瘤抗原和使用CD28或4-1BB共刺激的CAR以及在表达工程化T细胞受体(TCR)的T细胞中也观察到类似的效果。在许多模型系统中,具有干性(stemness)表型和转录组特征的T细胞显示出更高的抗肿瘤效力,然而,MED12缺失的T细胞显示出干性减弱和增强的效应细胞表型和转录组特征。与效应细胞的表型一致,MED12缺失的T细胞显示出增强的代谢活性和效力,其特点是糖酵解、氧化磷酸化和备用呼吸能力增加。MED12缺失的T细胞在长期培养和在体外和体内反复暴露于肿瘤后表现出持续的效力。小分子介导的对细胞周期蛋白依赖性激酶8和19(CDK8/19)---中介体复合物激酶模块的催化亚基---的抑制同样增加了健康的非工程化T细胞的增殖。
为了为理解这些观察结果提供基础,这些作者评估了MED12缺失的T细胞中染色质可及性和修饰的变化。通过使用染色质免疫沉淀测序,他们证实中介体复合物激酶模块和中介体复合物核心模块(core Mediator)在野生型CAR-T细胞中基本是共定位的,但MED12的缺失增加了中介体复合物核心模块在800多个基因组区域的染色质占用。这与已知的中介体复合物激酶模块在调节中介体复合物核心模块和RNA聚合酶II(RNAPII)之间的相互作用是一致的,并导致了这样的假设:T细胞中MED12或CCNC的缺失会选择性地减少中介体复合物核心模块和RNAPII之间的立体阻碍,从而增加转录和调节T细胞功能。与此相一致的是,在MED12缺失的CAR-T细胞中,MED1染色质占有率增加的区域表现为H3K27乙酰化增加,并且富集了在T细胞命运中起关键作用的转录因子---包括几个STAT和AP-1家族成员---所使用的增强子。在MED12缺陷的T细胞中,观察到最明显的增强是STAT5,它表现为对IL-2的敏感性增加。非工程化T细胞对IL-2的敏感性增加也可能是由于接触小分子CDK8/19抑制剂。
2. Science子刊:开发出CAR联合筛选方法,确定最有效治疗癌症的CAR-T细胞
近年来,经过基因改造的免疫细胞---配备了识别和摧毁肿瘤细胞的分子武器---已经改变了癌症治疗的面貌。如今,在一项新的研究中,来自美国加州大学旧金山分校的研究人员开发出一种新的方法来比较大量的CAR-T细胞,每种CAR-T细胞的分子特征略有不同,以确定哪种CAR-T细胞对癌症最有效和最持久(Science Translational Medicine, 2022, doi:10.1126/scitranslmed.abm1463)。
在这项新的研究中,这些作者开发出这种称为CAR联合筛选(CAR Pooling)的方法来研究具有40种不同嵌合抗原受体(CAR)的CAR-T细胞。这种在可以在未来扩大到测试数百或数千种受体组合的筛选发现了新的和令人惊讶的CAR,使这些治疗性CAR-T细胞更加强大。
论文通讯作者、加州大学旧金山分校微生物学与免疫学副教授Kole Roybal博士说,“CAR-T细胞对很多血癌患者来说绝对是一种变革。这项新的研究为以更聪明的方式设计这些细胞以便它们能更好、更持久地发挥作用并用于治疗更多的癌症类型奠定基础。”
3. Science子刊:1期临床试验表明经过CRISPR基因编辑的通用CAR-T细胞可用于治疗复发性B细胞白血病
在一项新的临床研究中,来自英国大奥蒙德街儿童医院和伦敦大学学院的研究人员利用CRISPR/Cas9技术对供者T细胞进行基因改造,试图治疗患有耐药性白血病的重症儿童,这些儿童已用尽所有可用的治疗方法。这项I期临床试验是首次在人类身上使用“通用的”经过CRISPR基因编辑的T细胞,代表着在使用基因编辑细胞治疗癌症方面迈出了重要一步。作为这项临床试验的一部分,他们构建并应用了新一代的更精确的“通用”基因组编辑T细胞(Science Translational Medicine, 2022, doi:10.1126/scitranslmed.abq3010)。

图片来自Science Translational Medicine, 2022, doi:10.1126/scitranslmed.abq3010。
这些作者使用CRISPR对T细胞进行了基因修饰,具体而言它对T细胞的DNA进行切割并插入了一段遗传代码。在这种情况下,这段遗传代码允许T细胞表达一种识别癌变B细胞表面上的一种称为CD19的标志物的嵌合抗原受体(CAR),所产生的CD19 CAR-T细胞摧毁这些癌变B细胞。他们随后利用CRISPR破坏了CD19 CAR-T细胞中的T细胞受体α链并移除它们的CD52,由此获得TT52CAR19 T细胞,这样构建出一种通用的可以“现成”使用的CAR-T细胞疗法,而无需任何供者匹配。
在首批接受TT52CAR19 T细胞治疗的6名儿童中,有4人在28天内进入缓解期,这使他们能够接受造血干细胞移植。在这4名儿童中,2人分别在治疗后9个月和18个月内仍在持续缓解,而不幸的是,另外2人在造血干细胞移植后复发了。在这项新的临床研究中,整体的副作用在预期之内,并在医院得到控制,有1名儿童需要短期的重症监护。
4. Nature:首次使用非病毒精确基因组编辑开发出的neoTCR-T细胞在临床试验中治疗实体癌并取得积极进展
人类免疫系统在T细胞表面上有特定的受体,即T细胞受体(TCR),可以专门识别癌细胞并将它们与正常细胞区分开来。这些受体对每名患者来说都是不同的,因此找到一种有效的方法来分离它们并将它们导入到T细胞中,以产生一种个性化的T细胞疗法来治疗癌症,是使这种方法大规模可行的关键。
在一项新的研究中,来自美国加州大学洛杉矶分校和PACT制药公司的研究人员首次开发了一种基于CRISPR/Cas9非病毒精确基因组编辑的临床级方法,同时敲除T细胞中的两个内源性TCR基因:TCRα(TRAC)和TCRβ(TRBC),并在TRAC基因座上插入新抗原特异性TCR(neoantigen-specific TCR, neoTCR)的两条链,所使用的neoTCR是从患者自身的循环T细胞中分离出来的,由此获得的T细胞称为neoTCR-T细胞(Nature, 2022, doi:10.1038/s41586-022-05531-1)。
图片来自Thomas Splettstoesser (Wikipedia, CC BY-SA 4.0)。
16名难治性实体癌(包括结肠癌、乳腺癌和肺癌)患者首次在neoTCR-T细胞剂量递增的1期临床试验(NCT03970382)中接受了多达三种不同的neoTCR-T细胞输注,每种neoTCR-T细胞都表达了患者特异性的neoTCR。一名患者出现了1级细胞因子释放综合征,一名患者出现了3级脑炎。在接受neoTCR-T细胞输注前,所有患者都接受清除淋巴细胞的化疗,并且在化疗后出现预期的副作用。在接受neoTCR-T细胞输注后,5名患者病情稳定,其他11名患者出现疾病进展。在接受neoTCR-T细胞治疗后的肿瘤活组织中检测到neoTCR-T细胞,其频率高于治疗前表达内源性TCR的T细胞。
这项新研究证实了分离和克隆多种识别突变新抗原的neoTCR、利用单步骤非病毒精确基因组编辑同时敲除内源性TCR和敲入neoTC和以临床等级制造neoTCR-T细胞的可行性,输注多达三种neoTCR-T细胞产品的安全性,以及将neoTCR-T细胞递送患者体内肿瘤中的能力。
5. NEJM:小型临床试验表明靶向GPRC5D的CAR-T细胞可有效治疗骨髓瘤
在一项新的研究中,来自美国纪念斯隆-凯特琳癌症中心(MSK)、丹娜-法伯癌症研究所和罗斯威尔公园综合癌症中心的研究人员指出一种利用对免疫系统中的T细胞进行基因改造后获得的CAR-T细胞疗法靶向一种有点神秘的细胞蛋白---GPRC5D抗原,该方法在对多发性骨髓瘤患者的首次临床试验中产生了令人瞩目的结果。
这些作者报告说,这种靶向GPRC5D的CAR-T细胞疗法在参加这项临床试验的17名出现肿瘤复发或对以前的疗法有抵抗力的骨髓瘤患者中让70.6%的人获得了缓解。许多获得缓解的患者之前在接受靶向BCMA的上一代CAR-T细胞疗法治疗后出现肿瘤复发。这些发现促使人们开始对这种靶向GPRC5D的新疗法在骨髓瘤患者中进行更大规模的临床试验。
论文第一作者Sham Mailankody说,“CAR-T细胞疗法是治疗癌症的最有前途的方法之一。虽然这项临床试验仍处于早期阶段,但我们对这些结果感到鼓舞,因为治疗后的测试显示,6名参与者对这种新的疗法有完全的反应,12名患者的癌症出现了可测量的下降。”
6. Nat Med:双靶向CAR NK细胞有望阻止NK细胞功能衰竭和肿瘤逃逸
在一项新的研究中,来自美国德克萨斯大学MD安德森癌症中心的研究人员开发了一种新方法:除了对自然杀伤细胞(NK细胞)进行基因改造使之表达一种识别肿瘤抗原的嵌合抗原受体(CAR)之外,还对它们进行进一步基因改造使之表达一种抑制NK细胞自我识别的作为逻辑门起作用的CAR,这样就使得这种双靶向CAR NK细胞需要两种信号才能杀死靶细胞。在临床前实验中,这种下一代CAR NK细胞通过克服一种导致NK细胞功能障碍和肿瘤复发的过程,改善了肿瘤的特异性并增强了抗肿瘤活性。
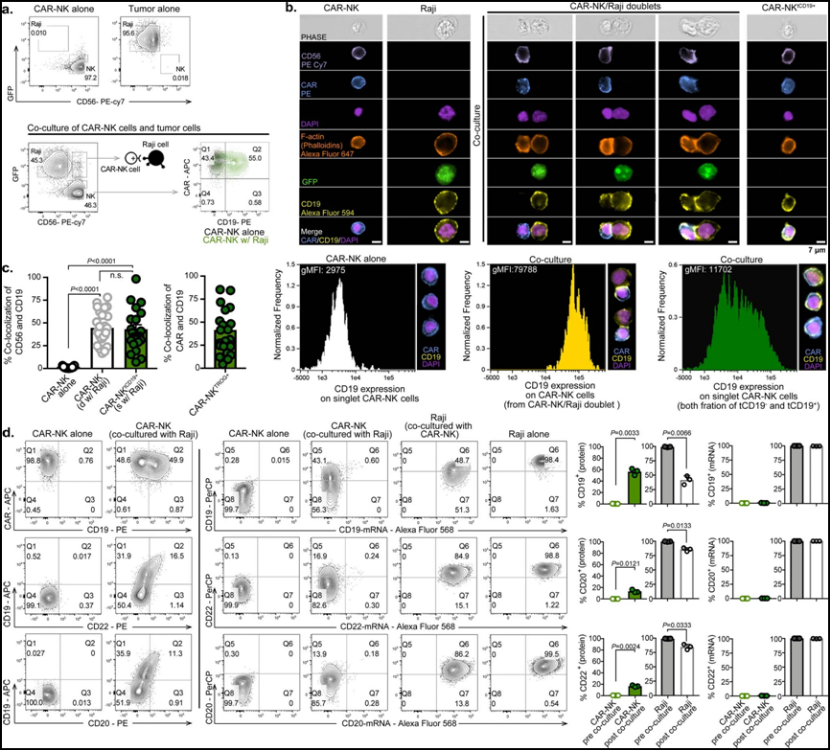
在体外,CAR介导的NK细胞中的CD19胞啃作用。图片来自Nature Medicine, 2022, doi:10.1038/s41591-022-02003-x。
这项新的研究表明,一种称为“胞啃作用(trogocytosis)”的正常生理过程通过导致肿瘤抗原丢失、CAR NK细胞功能衰竭和自相残杀,导致了肿瘤逃逸和CAR NK细胞治疗后反应不佳。为了阻止这一过程的发生,这些作者给CD19 CAR NK细胞添加了一种旨在识别NK细胞特有的标志物的抑制性CAR,导致CAR NK细胞彼此之间在互动时收到“不要杀我”的信号,即使它们的表面携带肿瘤抗原。在临床前模型中,这些受到逻辑门控制的双靶向CAR NK细胞能够更好地专注于并只攻击肿瘤细胞,减少NK细胞功能衰竭和自相残杀的频率,并提高抗肿瘤活性。
7. Nature:重大进展!我国科学家开发出非病毒的基因特异性靶向CAR-T细胞,并在临床试验中证实它们可安全有效地治疗复发/难治性B细胞非霍奇金淋巴瘤
近年来,嵌合抗原受体(CAR)T细胞(CAR-T)疗法迅速发展,它在癌症治疗中显示出巨大的潜力。然而,一些局限性仍然存在,包括目前的CAR-T细胞疗法的复杂制造过程、高生产成本、较长的制备时间和潜在的安全问题。在CAR-T细胞生产中使用病毒是一个令人担忧的领域,因为这种方法的缺点包括插入突变导致的肿瘤产生风险增加。此外,对病毒DNA的特异性反应往往会阻碍CAR的表达,而且病毒制备本身经常会产生高额费用。尽管一些不使用病毒的策略,如使用转座子系统和mRNA转导,正在用来产生CAR-T细胞,但随机整合和CAR表达中断导致的CAR-T细胞同质性较低成为额外的问题。近期,一些研究表明,通过使用腺相关病毒(AAV)载体作为模板,可以应用基因组编辑技术来产生基因座特异性整合的CAR-T细胞。此外,有人提出了一种优选的非病毒策略,以产生可校正点突变和精确插入T细胞受体(TCR)的T细胞产品。
为了同时解决病毒使用和随机整合的缺点,来自中国浙江大学和华东师范大学等研究机构的研究人员利用CRISPR-Cas9开发出非病毒的、基因特异性靶向CAR-T细胞,并一项1期开放标签的单臂临床试验中证实它们在治疗8名复发/难治性B细胞非霍奇金淋巴瘤(relapsed/refractory B cell non-Hodgkin lymphoma, r/r B-NHL)患者中的高安全性和有效性。
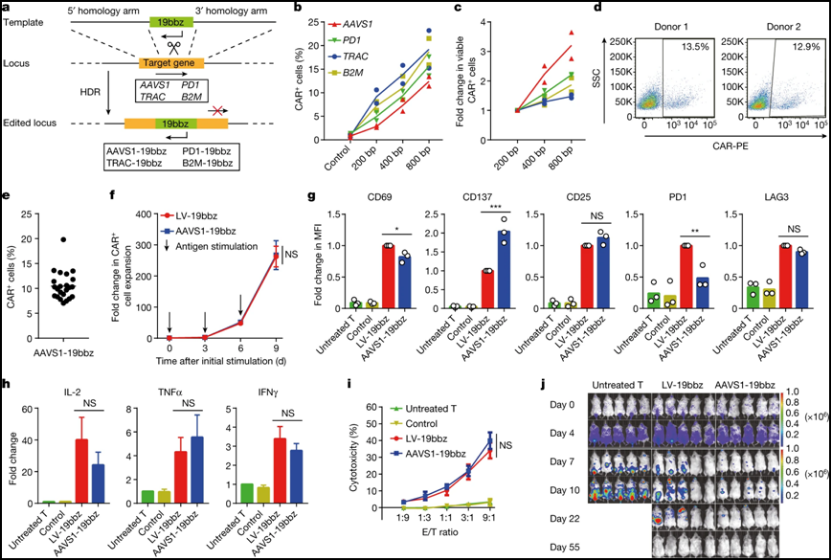
非病毒的将CAR整合到AAVS1基因中的CAR-T细胞有效消除肿瘤细胞。图片来自Nature, 2022, doi:10.1038/s41586-022-05140-y。
据这些作者的说法,他们是世界上首次在临床试验中证实非病毒的、基因特异性靶向CAR-T细胞的安全性和有效性的。通过使用非病毒的、将靶向CD19的CAR整合到PD1基因中的CAR-T细胞(PD1-19bbz CAR-T细胞),他们发现接受这些CAR-T细胞治疗的r/r B-NHL患者具有显著的安全性,只有较低的轻度细胞因子释放综合征(CRS)发生率,并且没有发生神经系统毒性。他们的临床前实验也表明不论肿瘤细胞是否较高地表达PD-L1,PD1-19bbz CAR-T细胞都能高效地清除它们。这些研究结果也与之前报道的两项临床试验一致,因而进一步证实了CRISPR-Cas9应用于T细胞治疗的安全性。与此同时,他们观察到较高的完全缓解率和持久的完全缓解。特别是在两名PD-L1高表达的r/r B-NHL患者中发现了反应(尽管后来一名患者发生了CD19-肿瘤复发)。令人惊讶的是,尽管初始的PD1-19bbz CAR-T细胞剂量(没公斤体重输注2×106个细胞)出乎意料地低,或者由于早期和仍然不成熟的制造过程导致CAR+细胞的比例很低,但是在12个月的中位观察期间,8名患者中有7人实现了完全缓解,这表明这些PD1-19bbz CAR-T细胞具有更强的杀死肿瘤细胞的效力。
8. Nature:重大进展!抑制RASA2基因可让T细胞在肿瘤微环境中持续杀死癌细胞,有望治疗一系列实体瘤和液体肿瘤
用于免疫治疗的T细胞会因为对抗癌细胞的任务而变得功能衰竭,或者在进入肿瘤时失去活性。在一项新的研究中,通过对这些细胞的基因组进行基于CRISPR的编辑,来自美国加州大学旧金山分校、格拉斯通研究所和以色列特拉维夫大学的研究人员使这些治疗性的T细胞变得更有活力。这一发现可能有助于克服限制这种有希望的疗法成功遏制实体瘤和液体肿瘤的一个主要因素。
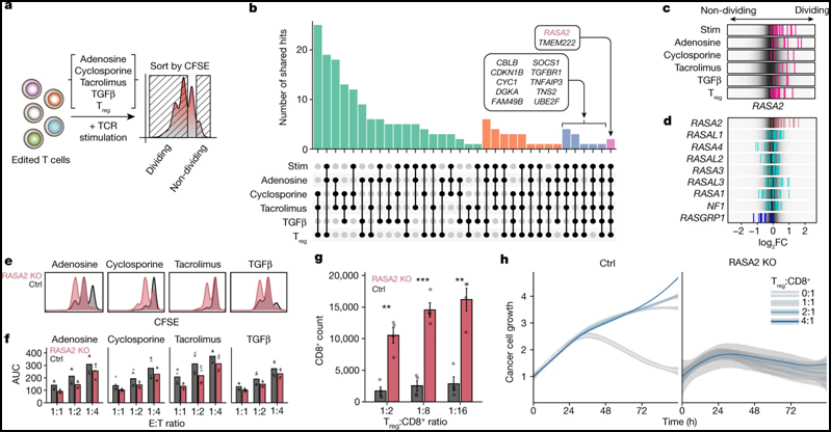
在原代人T细胞中进行的多种全基因组CRISPR筛选发现RASA2是一种抵抗免疫抑制环境的调节因子。图片来自Nature, 2022, doi:10.1038/s41586-022-05126-w。
这些作者构建出敲除RASA2基因的T细胞。他们然后让这些T细胞接受各种 “应激测试”,让它们反复暴露在癌细胞以及肿瘤微环境模型中。他们将这些RASA2基因敲除的T细胞的表现与仍然含有正常RASA2基因的原始治疗性T细胞的表现进行了比较。在原始的T细胞失去抗癌能力很久之后,RASA2基因敲除的T细胞仍然非常不知疲倦。
这些作者在对不同类型的阻断RASA2的工程化T细胞进行了测试以及对来自许多不同人类供者的T细胞以及液体癌症和实体瘤模型进行了测试,他们获得的结果是一致的。Carnevale说,“这些敲除RASA2基因的T细胞可以持续杀死癌细胞。我们似乎找到了T细胞功能的抑制因子,当我们去除它时,我们就能释放出这些治疗性T细胞的潜力。”
9. Science子刊:重大进展!注射一种水凝胶有望治疗胶质母细胞瘤
在一项新的研究中,美国威斯康星大学麦迪逊分校药学院药物科学部助理教授Quanyin Hu及其研究团队开发出一种水凝胶,在人类胶质母细胞瘤小鼠模型中它可以被注射到切除肿瘤后留下的脑腔中。这种水凝胶含有携带着编码嵌合抗原受体(CAR)的基因的纳米颗粒,这些纳米颗粒旨在进入某些类型的免疫细胞---称为巨噬细胞---并使它们表达可以靶向胶质瘤干细胞的CAR,由此产生的巨噬细胞称为CAR巨噬细胞(CAR macrophage, CAR-M)。这些免疫细胞通常会清理体内的传染性入侵者,但在肿瘤环境中,它们可能会转变为抑制免疫系统和促进癌症生长的形式。由于手术造成的炎症,这些叛变的巨噬细胞会涌向手术部位,可能会助长癌症复发。
为了让这些巨噬细胞从敌人变成盟友,这些纳米颗粒进入这些巨噬细胞并使它们表达的CAR靶向一种叫做CD133的糖蛋白,这是胶质瘤干细胞的一种标志物。Hu及其研究团队还添加了一种CD47抗体,它能阻止“不要吃我”的信号,从而促进CAR-M细胞识别癌细胞。针对小鼠模型的临床前结果显示这种水凝胶治疗成功地产生了胶质瘤干细胞特异性的CAR-M细胞 ---本质上就是在现场对巨噬细胞进行重编程,使之靶向并杀死任何残留的胶质瘤干细胞。
10. Blood:不表达CD7的CAR-T细胞有望更好地治疗T-ALL白血病
在一项新的研究中,来自美国圣犹大儿童研究医院的研究人员改进了嵌合抗原受体(CAR)T细胞(CAR-T)疗法。他们新的简化方法选择了一种有利的T细胞类型,并在实验室中显示出对抗复发的T细胞急性淋巴细胞白血病(T-ALL)的前景。

图片来自Blood, 2022, doi:10.1182/blood.2021015020。
几种治疗复发性T-ALL的CAR-T细胞疗法靶向抗原CD7。这种抗原存在于许多T-ALL癌细胞表面上,就像这些癌细胞挥舞着同样的旗帜一样。然而,有一个问题。论文共同第一作者、圣犹大儿童研究医院的Abdullah Freiwan说,“大多数正常T细胞也表达CD7,而且因为这些CAR-T细胞战士完全听从命令。它们会杀死任何携带这种特定标志物的细胞,即使这意味着互相残杀。”
这些作者专注于一小群天然不表达CD7的T细胞。他们产生了一种选择和扩大这些细胞的方法,然后将它们制成CAR-T细胞。在实验室研究中,这些不表达CD7的CAR-T细胞表现非常好,有效地清除了肿瘤。在小鼠模型的癌症复发实验(再挑战)中,这些细胞还提供了长期保护。
11. Cell Stem Cell:重磅!科学家有望制造出更好的现成可用的CAR-T细胞来用于癌症免疫疗法
在CAR-T细胞免疫疗法中,来自患者自身血液中的T细胞能被工程化改造为携带嵌合抗原受体(CAR),从而增强T细胞攻击和杀灭肿瘤细胞的能力,当CAR-T细胞疗法能作为治疗特定白血病和淋巴瘤的强大手段时,很多病人仍然无法使用这种有效的疗法。在一项新的研究中,来自美国波士顿儿童医院等机构的研究人员通过研究或有望让CAR-T细胞疗法能够更加广泛地使用。
本文研究中,研究人员就利用诱导多能干细胞(iPSC)开发了一种新方法来制造通用型的CAR-T细胞,其或能大规模生产并用于多名患者的治疗。在研究涉及血液发育的表观遗传学因素时,研究人员锁定了一种名为EZH1的酶类,其能限制成熟淋巴细胞的分化,而抑制EZH1则能促使iPS细胞制造成熟的T细胞,同时研究人员还开发了一种新型培养系统,其能避免与鼠源性细胞共培养,因为后者的培养较为困难,而且产生的T细胞也并不够成熟。
当iPS细胞衍生的T细胞被进一步转化为CAR-T细胞时,其所显示出的抗肿瘤活性就与目前用于临床疗法的方法所产生的CAR-T细胞的抗肿瘤活性相当,当与此前iPS细胞方法所制造的T细胞相比,这些新细胞在实验室中杀灭癌细胞和清除活体小鼠癌细胞的能力都有所增强。研究者Daley表示,经过多年的研究,如今我们发现iPS细胞最终或能帮助开发用于治疗诸如癌症等多种人类疾病的新型疗法。
12. Nature:发现cBAF与c-Myc相互作用让T细胞变成记忆T细胞,有望利用CAR-T细胞治疗实体瘤
在一项新的临床前研究中,来自圣犹大儿童研究医院的研究人员发现了一种分子机制,该机制开启了CAR-T细胞疗法治疗实体瘤的前景。
论文共同通讯作者、圣犹大儿童研究医院免疫学系主任Doug Green博士说,“我们的研究从T细胞的基础生物学延伸到了可能的临床应用,并在此过程中探索深层的分子机制。我们发现,就像我们很多人一样,如果你是一个被激活的T细胞,你生命早期发生的事情会影响你以后的发育。我们发现,在T细胞激活早期,蛋白c-Myc和复合物cBAF之间的相互作用影响细胞的命运轨迹。”
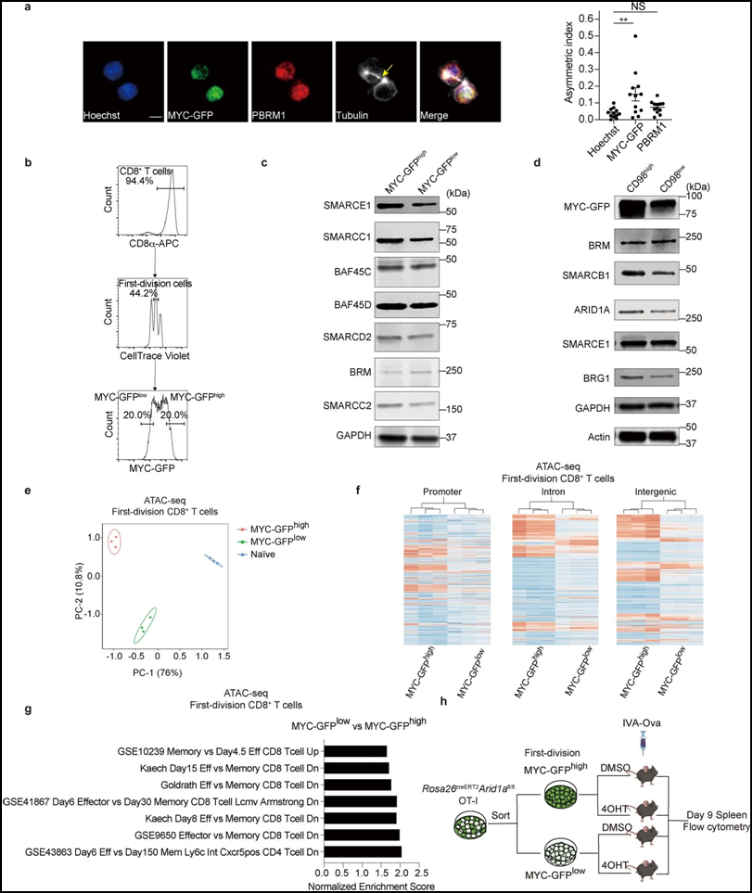
cBAF成分在激活后第一次分裂时不对称地分离到子细胞。图片来自Nature, 2022, doi:10.1038/s41586-022-04849-0。
这些作者利用他们发现的分子信息来提高CAR-T细胞的功效。他们在CAR-T细胞激活期间使用了一种cBAF抑制剂,以让它们产生更多的记忆T细胞。在一种临床前模型中,经这种cBAF抑制剂处理的CAR-T细胞比未经处理的CAR-T细胞更能控制肿瘤的生长。经这种cBAF抑制剂处理的CAR-T细胞也存活得更久,数量也更多。它们在多种实体瘤类型中重现了这一令人鼓舞的结果。这项新的研究是首批显示CAR-T细胞可以被短暂修改以更有效地杀死实体瘤的研究之一。
13. Nature:干扰素γ受体受体信号通路可让CAR-T细胞高效杀伤实体瘤
在一项新的研究中,来自麻省总医院(MGH)的研究人员发现,干扰素γ受体(IFNgR)信号通路对于胶质母细胞瘤对CAR-T细胞免疫疗法的易感性至关重要。在其他实体肿瘤中也观察到了同样的现象。这一发现可能部分地解释了为何液体肿瘤和实体瘤对CAR-T细胞治疗的反应非常不同。
当他们在多个胶质母细胞瘤细胞系(包括来自患者的几个细胞系)中进行这种CRISPR敲除筛选时,他们意外地发现,IFNgR信号通路中的基因缺失使它们对CAR-T细胞的杀伤产生了抵抗力。在体内的基因敲除小鼠模型中也发现了这种相同的抵抗模式。在包括胰腺癌、卵巢癌和肺癌在内的其他实体瘤类型中的进一步研究也显示了同样的情况:对CAR-T细胞疗法的抵抗是由于IFNgR信号通路基因的丧失。相反,他们观察到,IFNgR信号通路对白血病、淋巴瘤或多发性骨髓瘤对CAR-T细胞疗法的敏感性没有作用。这表明实体瘤和液体肿瘤对CAR-T细胞疗法的反应方式不同,这人们如何设计未来的疗法非常有参考价值。
14. Cell:重磅!下一代癌症免疫疗法即将问世!开发出远程控制的CAR-T细胞,有望更安全更有效地治疗实体瘤
在一项新的针对小鼠的研究中,来自斯坦福大学医学院的研究人员发现一种利用患者自身的经过基因修饰的免疫细胞来攻击癌细胞的癌症治疗方法,当可以通过口服药物进行开启和关闭时,会更安全和更有效。
这些作者设计出一种经过基因修饰的CAR-T细胞疗法---称为SNIP CAR-T,它可用一种已经被美国食品药品管理局(FDA)批准用于人体的抗肝炎口服药物激活。如果没有这种药物,SNIP CAR-T细胞就没有活性。

图片来自Cell, 2022, doi:10.1016/j.cell.2022.03.041。
论文通讯作者、斯坦福大学儿科教授Crystal Mackall博士说,“我们构建出一种‘远程控制’的CAR-T细胞疗法,可针对每名患者进行调整。这些经过基因修饰的CAR-T细胞不仅更安全,而且比原来的CAR-T细胞更有效力,用途更广。这是一种相当复杂的系统。”
论文第一作者Louai Labanieh说,“我对SNIP CAR-T细胞优于传统CAR-T细胞疗法的程度感到惊讶。在传统CAR-T细胞完全失败的地方,SNIP CAR-T细胞完全治愈了小鼠骨骼和神经系统中的实体瘤。”
15. NEJM:病例研究表明TCR-T细胞有望治疗胰腺癌
在一项新的实验中,一名患有晚期胰腺癌的名叫Kathy Wilkes的女性在来自美国国家癌症研究所和普罗维登斯癌症研究所的研究人员对她自身的免疫细胞进行功能强化后,看到她的肿瘤急剧缩小,这突出说明了有朝一日一种潜在治疗各种癌症的新方法。
他们从Wilkes的血液中提取T细胞,在实验室中对它们进行基因改造而表达这种TCR,然后在体外培育出数十亿个表达这种TCR的T细胞,即TCR-T细胞。在输注由此产生的TCR-T细胞6个月后,她的肿瘤缩小了72%,而且Wilkes说最近的检查显示她的病情仍然稳定。
16. Cell:重磅!下一代更智能的细胞疗法出炉!表达模块化SNIPR受体的CAR-T细胞可高效杀死实体瘤,同时减少毒副作用
基于工程化免疫细胞(即经过基因改造的免疫细胞)的疗法最近成为治疗癌症的一种有希望的方法。与传统药物相比,工程化免疫细胞在检测和消除癌细胞的能力方面更加精确和精密。然而,尽管前景广阔,基于细胞的疗法仍然面临重要的限制,包括毒性和它们可能攻击健康细胞的可能性。此外,科学家们并没有很好地掌握如何对现有的治疗性细胞(therapeutic cell)进行基因修饰,以扩它们的应用范围或更好地控制它们的活性。
为了克服这些限制,格拉德斯通研究所和加州大学旧金山分校的研究人员在一项新的研究中对用于设计治疗性细胞的分子构件进行了系统分析。他们的研究为设计具有更高特异性和安全性的治疗性细胞,以及最终定制基于细胞的治疗方法制定了全面的规则手册。
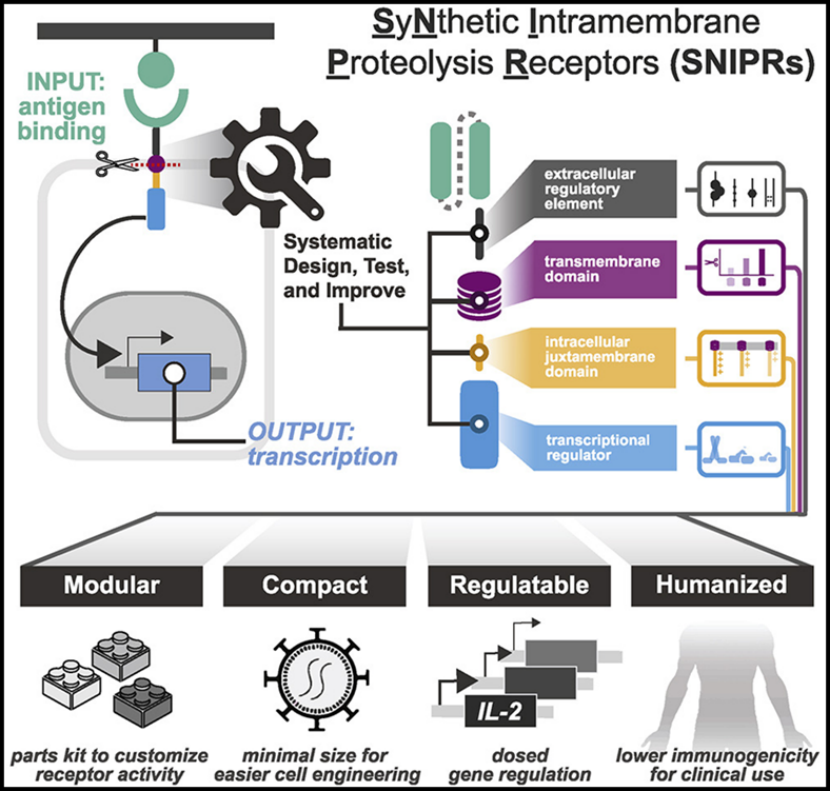
图片来自Cell, 2022, doi:10.1016/j.cell.2022.03.023。
论文通讯作者、加州大学旧金山分校微生物学与免疫学系副教授Kole Roybal博士及其团队构建出一个他们称之为SNIPR(synthetic intramembrane proteolysis receptor,合成膜内蛋白分解受体)的受体的目录,这些受体足够小,可以在人类细胞中进行低成本的工程化。它们也完全由人类受体片段制成,可以检测和响应少量的靶标。此外,SNIPR的活性可以被调整,以便携带它们的细胞不只是杀死靶细胞,而且还可以将特定的分子递送到精确的疾病位置。
这些作者接下来评估了这些优化的受体在白血病、间皮瘤和卵巢癌的小鼠模型中清除肿瘤的能力。为了减少杀死非靶细胞的机会,他们将经设计后用于识别肿瘤表面上的一种分子的SNIPR与经基因改后识别另一种肿瘤分子的CAR受体相结合。此外,他们使CAR受体的产生依赖于SNIPR受体的激活。这样,只有携带synNotch和CAR受体的作用靶标的细胞才会被杀死,而只携带其中的一种作用靶标的细胞则不会被杀死。
17. Nature:重磅!对免疫系统进行重编程,有望设计出新一代更高效抵抗血癌和实体瘤的CAR-T细胞疗法
美国食品药品管理局(FDA)批准上市的第一批细胞疗法是活的药物:从癌症患者身上提取出来、然后经过经基因改造后靶向攻击肿瘤细胞的免疫细胞。然而,对于许多患者来说,这些先进的疗法并没有带来持久的缓解。如今,在一项新的研究中,来自美国纽约基因组中心和纽约大学的研究人员开发出一种基因筛选平台,以确定能够增强免疫细胞的基因,使它们在体内能够更加持久存在,并提高它们根除肿瘤细胞的能力。
在这篇论文中,这些作者描述了合成基因程序的发现,这些基因程序深刻地重塑了一类特定的称为T细胞的免疫细胞,使它们更有效地寻找和对抗癌细胞。在论文通讯作者、纽约基因组中心核心成员、纽约大学生物学助理教授Neville Sanjana博士的领导下,他们剖析了来自人类供者的多个T细胞亚群中近12000个不同基因的影响。这一大规模基因筛选的目的是准确识别那些使T细胞增殖的基因,并了解这些基因如何影响与抗癌有关的免疫细胞功能的其他方面。
通过将筛选中发现的修饰基因与现有的CAR相结合,这些作出能够设计出更有效地消除肿瘤细胞的T细胞。一个特殊的修饰基因,即LTBR(lymphotoxin beta receptor),起着分子青春之泉的作用:有了LTBR,T细胞就会增殖,拥有更大比例的更年轻、更类似干细胞的细胞,并抵制随着时间推移而变得功能衰竭。添加LTBR还使T细胞分泌更多的细胞因子,这对T细胞的抗肿瘤活性至关重要。细胞因子在使T细胞更好地与体内其他免疫细胞沟通并对癌症发起协调攻击方面发挥着重要作用。有趣的是,LTBR在T细胞中通常不表达,这凸显了基因组规模筛选在找到激活全新细胞程序的基因方面的力量。
18. Nature:揭示CAR-T细胞可在人体内持续存在至少10年,并实现白血病持续缓解
2010年夏天,Bill Ludwig和Doug Olson正在与一种叫做慢性淋巴细胞白血病(CLL)的凶恶血癌作斗争。他们都接受了许多治疗,由于剩下的治疗选择越来越少,他们自愿成为美国宾夕法尼亚大学艾布拉姆森癌症中心和佩雷尔曼医学院正在进行的一项实验性疗法临床试验的首批参与者。该疗法将根除他们的晚期白血病,成为全球的头条新闻,并开创一个高度个性化的医学新时代。
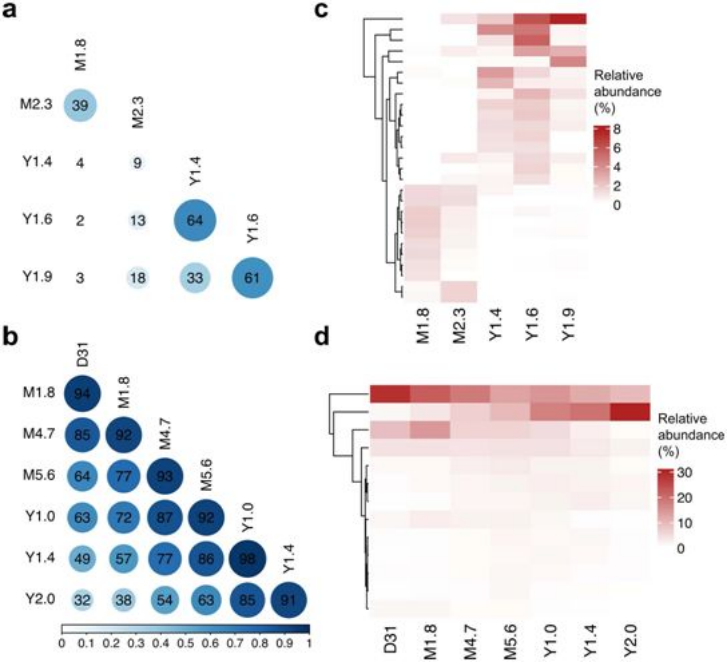
基于T细胞受体测序数据,分析患者1、2体内的CAR-T细胞克隆进化。图片来自Nature, 2022, doi:10.1038/s41586-021-04390-6。
在这种称为嵌合抗原受体(CAR)T细胞(CAR-T)疗法的实验性疗法中,经过基因改造的靶向肿瘤细胞的T细胞是用每名患者自己的T细胞为他们制作的活体药物。如今,在一项新的研究中,来自宾夕法尼亚大学和费城儿童医院的研究人员发表了对这两名患者的分析,解释了CAR-T细胞疗法记录到目前为止对CLL的最长持续时间,并显示CAR-T细胞在输注到患者体内后至少十年仍可检测到,这两名患者的病情持续缓解。
论文共同第一作者兼论文共同通讯作者、宾夕法尼亚大学佩雷尔曼医学院病理学与检验医学教授J.Joseph Melenhorst博士说,“这种长期缓解是了不起的,见证患者无癌生活证明了这种有效对抗癌细胞的‘活体药物’的巨大效力。目睹我们的患者对这种创新的细胞疗法反应良好,我们所有的努力都是值得的。能够让他们有更多的时间生活,并与亲人一起度过。”
19. Science:重大突破!注射脂质纳米颗粒封装的mRNA在体内产生CAR-T细胞,可显著逆转心脏纤维化
在一项新的研究中,来自美国宾夕法尼亚大学佩雷尔曼医学院的研究人员发现类似于基于信使RNA(mRNA)的COVID-19疫苗,一种实验性免疫疗法只需注射一次mRNA就能暂时重编程患者的免疫细胞以攻击特定靶标。
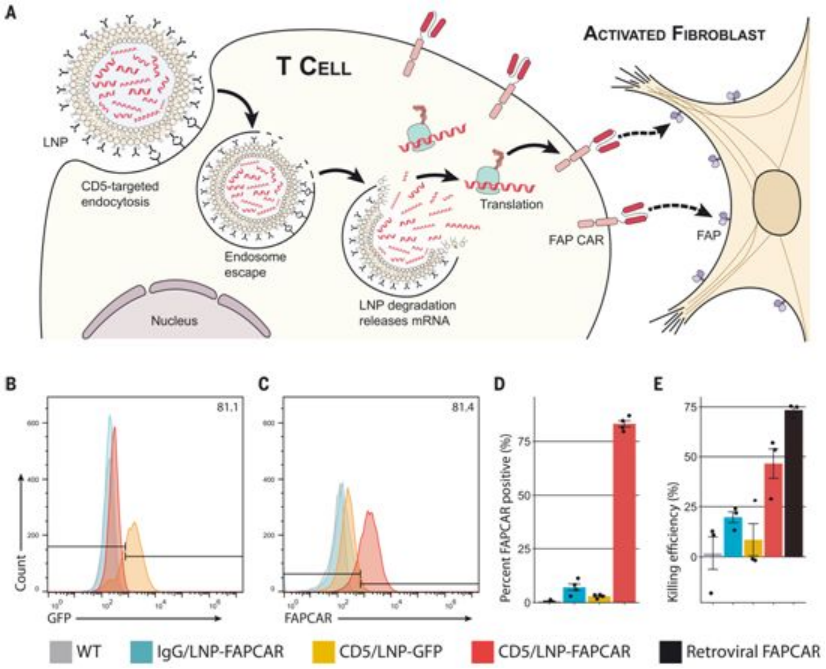
靶向CD5的脂质纳米颗粒在体外产生功能性的、基于mRNA的FAPCAR T细胞。图片来自Science, 2022, doi:10.1126/science.abm0594。
这些作者证实这种新方法利用mRNA制剂重编程这种强大的称为T细胞的免疫细胞,经过重编程的T细胞可以攻击心脏成纤维细胞。心力衰竭通常部分上是由这些成纤维细胞驱动的,它们对心脏损伤和炎症作出的反应是长期过度地产生纤维物质,使心肌变硬,从而损害心脏功能---这种情况称为纤维化(fibrosis)。在模拟心力衰竭的小鼠实验中,这些经过重编程的T细胞引起的心脏成纤维细胞的减少导致了心脏纤维化的显著逆转。
20. Cancer Cell:重大进展!新研究开发出可以根据需要开启或关闭的VIPER CAR-T细胞,有望更加安全地治疗癌症
为了使开创性的CAR-T细胞疗法对患者来说风险更小,Wong及其团队正在努力构建一个内置于CAR-T细胞设计中的安全开关。在一项新的研究中,这些作者揭示了一种新型的CAR-T细胞,它们可以被开启或关闭,从而有可能在严重副作用发生之前阻止细胞激活。
他们的新系统被称为VIPER(Versatile ProtEase Regulatable) CAR-T细胞。所设计的VIPER CAR-T细胞可以通过给患者提供一种破坏细胞活性的抗病毒药物来加以控制,减少了传统CAR带来的安全问题。Wong说,“我们把它看作是这种类型疗法的下一代。”
在所有的CAR-T细胞中,CAR的一部分伸出细胞膜外,而另一部分位于细胞内。伸出细胞膜外的这一部分与癌症抗原结合,然后激活T细胞并摧毁癌细胞。VIPER CAR-T细胞在CAR附近插入了一个特殊的蛋白链。这些作者构建出两种不同的系统---一种是在VIPER CAR-T细胞转移回患者体内时开启,另一种是关闭。这两种系统的工作方式略有不同,但都可以通过患者服用美国食品药品管理局(FDA)批准的、通常用于治疗丙型肝炎的药物来关闭或开启。
论文共同第一作者、Wong实验室博士后Li Huishan说,“这是这项研究中最令人兴奋的部分,即抗病毒药物已经被FDA批准。”当给药时,这种药物分子与插入的这种蛋白链相互作用,从而在细胞中启动一系列反应,使它脱离,或激活,这取决于使用的是哪种系统。
21. Cancer Cell:粘液瘤病毒和CAR-T细胞/TCR-T细胞联手可诱导癌细胞自亡,有望更有效治疗实体瘤
在一项新的研究中,来自美国亚利桑那州立大学和威克森林大学医学院等研究机构的研究人员利用粘液瘤病毒(myxoma virus)将免疫疗法和病毒疗法相结合,为难治性癌症患者提供了新的希望。该方法涉及到两种方法的结合,这两种方法都对一些癌症显示出相当大的成功。该研究描述了溶瘤病毒疗法(一种使用抗癌病毒的技术)如何与现有的免疫治疗技术协同作用,提高免疫能力,有效地靶向和摧毁癌细胞。
这项新研究强调了免疫疗法与病毒疗法相结合时,能够突破癌症的抵抗力,特别是使用感染了粘液瘤病毒的CAR-T细胞或TCR-T细胞。粘液瘤病毒可以直接靶向并杀死癌细胞,但更有用的是可以诱导一种不寻常的T细胞定向细胞死亡形式,即自亡。这种形式的细胞死亡增强了T细胞诱导的其他两种程序性癌细胞死亡的形式,即细胞凋亡(apoptosis)和细胞焦亡(pyroptosis)。

图片来自Cancer Cell, 2022, doi:10.1016/j.ccell.2022.08.001。
在粘液瘤病毒介导的自亡期间,这种疗法靶向攻击的癌细胞附近的其他癌细胞也会在一种称为旁观者杀伤(bystander killing)的过程中被摧毁。这种效果可以显著提高这种双重疗法对癌细胞的积极根除效果,即使是在出了名的难以治疗的实体瘤中,也是如此。因此,这种联合使用粘液瘤病毒和免疫疗法的方法有可能将免疫系统无法检测到的“冷肿瘤”变成免疫细胞能够识别和摧毁的“热肿瘤”,从而使CAR-T细胞或TCR-T细胞进入肿瘤环境、增殖并激活。
22. Science子刊:利用TCR-T细胞靶向COL6A3蛋白的一种泛癌表位有望治疗一系列实体瘤
尽管过继性T细胞疗法被炒得沸沸扬扬,但要找到在不同肿瘤类型中一致性表达但在健康细胞中不表达的治疗靶标仍是一个挑战。如今,在一项新的研究中,来自美国宾夕法尼亚大学和德国Immatics生物技术公司(下称Immatics公司)的研究人员确定了一种泛癌抗原成分:COL6A3-FLNV,可以满足这两个条件。
在这项新的研究中,这些作者指出利用T细胞受体(TCR)T细胞(TCR-T)疗法靶向他们发现的一种泛癌抗原成分时,可以减缓小鼠的癌症生长。这种泛癌抗原成分在11种不同类型的实体瘤患者的肿瘤样本中大量存在,但在健康细胞中却很少存在,这使它成为T细胞疗法的主要潜在靶标。如今,Immatics公司计划向美国食品药品管理局(FDA)申请试验性新药,希望能启动1期临床试验。
有了他们的靶标,这些作者着手开发能够识别该表位而不攻击其他肽的TCR。他们再次利用Immatics发现平台的数据来比较肿瘤细胞和正常细胞之间的反应性,开发出高亲和力的TCR-T细胞,并将它们注射到接受人类白血病细胞移植的小鼠体内。癌症的生长速度减慢了,而且小鼠也没有出现严重的副作用。
23. Science子刊:利用水凝胶递送CAR-T细胞可改善对实体瘤的治疗
当前,一种令科学家们兴奋的前沿癌症治疗方法涉及收集和重编程患者的T细胞---一组特殊的免疫细胞---然后将它们灌注会相同的患者体内,准备检测和摧毁癌细胞。尽管这种方法对诸如白血病之类的一系列血癌很有效,但在治疗实体瘤方面却很少成功。

可注射的水凝胶为共同递送CAR-T细胞和细胞因子产生局部炎性微环境,以改善实体瘤治疗。图片来自Science Advances, 2022, doi:10.1126/sciadv.abn8264。
如今,在一项新的研究中,来自斯坦福大学的研究人员开发出一种增强经过基因修饰的免疫细胞---称为嵌合抗原受体(CAR)T细胞(CAR-T)---的“攻击力”的递送方法。他们将CAR-T细胞和专门的信号蛋白添加到水凝胶---一种充满水的凝胶,具有与生物组织相同的特征---中,然后将水凝胶注射到肿瘤旁边。这种水凝胶在体内提供了一种临时的炎性微环境(inflammatory niche),在那里,CAR-T细胞增殖和激活以准备对抗癌细胞。这种水凝胶就像漏水的握笔,泵出激活的CAR-T细胞,以便随着时间的推移不断攻击肿瘤。论文共同通讯作者、斯坦福大学材料科学与工程系助理教授Eric Appel说,“CAR-T细胞领域的很多研究工作都集中在如何制造更好的细胞本身,但对如何使细胞在体内更有效却关注得很少。因此,我们所做的完全是对设计更好细胞的所有努力的补充。”
24. Cell Metab:抑制胞啃作用可提高内源性T细胞和CAR-T细胞的抗肿瘤活性,阻止癌细胞逃避免疫检测
免疫系统不仅要对诸如病毒、细菌和寄生虫之类的外部入侵者,而且要对诸如癌症之类的内部威胁做出反应。然而,恶性肿瘤经常克服免疫系统的防御措施,并逃避免疫检测。在一项新的研究中,来自美国宾夕法尼亚大学等研究机构的研究人员发现了一种详细的机制,利用该机制肿瘤可以避开免疫系统和利用其力量的癌症疗法,如经过基因改造的CAR-T细胞。
这些作者揭示了肿瘤源性因子如何刺激胞啃作用(trogocytosis)。当T细胞与癌细胞相互作用时,它们有时可以“啃咬”一小片癌细胞膜。当这一小片癌细胞膜段包括一种抗原,即癌症特有的分子时,T细胞就可能开始在自己的细胞表面呈递该抗原,使得它在其他T细胞看来像一个癌细胞。
此前,人们认为胞啃作用与癌症阻碍抗癌免疫的能力有关,但是Fuchs团队确定了这一机制,表明暴露于肿瘤因子的T细胞经历了基因CH25H表达水平的明显下降。众所周知,该基因参与改变细胞的脂质膜,并能抑制两个细胞膜融合在一起,而这种细胞膜融合是发生胞啃作用的必要过程。当他们把CH25H产生的一种代谢物添加回去时,他们可以阻断胞啃作用。对该途径的进一步表征帮助Fuchs团队确定了另一个参与者,即ATF3基因,它拮抗CH25H的活性。消除AFT3能阻止胞啃作用的发生,并恢复了T细胞杀死肿瘤细胞的能力。
这些新的见解不仅为抗癌疗法提出了新的靶标,而且可能对CAR-T细胞疗法具有直接意义。由于胞啃作用可能会损害CAR-T细胞疗法中递送的工程化T细胞的有效性,这些作者推测,阻断这种作用可以提高CAR-T细胞的性能。Fuchs说,“我们想,为什么我们不使用被巧妙地称为‘装甲CAR(armored CAR)’的方法,并在CAR-T细胞中共同表达CH25H。事实证明,这比旧的CAR-T细胞更有效。”
25. Nature:合成的IL-9受体可让T细胞在不使用化疗或放疗的情形下在体内强劲杀死癌细胞
在接受旨在靶向癌性肿瘤(cancerous tumor)的T细胞治疗之前,病人的整个免疫系统必须被化疗或放疗破坏。由此产生的毒副作用是众所周知的,包括恶心、极端疲劳和脱发。
如今,在一项新的研究中,加州大学洛杉矶分校的Anusha Kalbasi博士领导的一个研究团队与斯坦福大学和宾夕法尼亚大学的研究人员合作,发现一种合成的IL-9受体允许这些抗癌的T细胞在不需要化疗或放疗的情况下发挥它们的作用。他们指出,在斯坦福大学的Christopher Garcia博士实验室里设计的携带这种合成IL-9受体的T细胞强效地杀死小鼠体内的肿瘤。

图片来自Nature, 2022, doi:10.1038/s41586-022-04801-2。
Kalbasi说,“当T细胞通过这种合成IL-9受体发出信号时,它们获得了新的功能:不仅能帮助它们战胜现有的免疫系统,还能更有效地杀死癌细胞。在此之前,病人挣扎着接受有毒的化疗,只是为了消灭他们体内现有的免疫系统,以便让T细胞疗法能够有机会战斗。但有了这项新的技术,就可能会给予T细胞治疗,而不必事先消灭现有的免疫系统。”
其实,科学家们针对细胞治疗领域的研究不胜枚举,以上罗列的仅是其中的一小部分。当然,其中的一些涉及细胞治疗的研究仅局限在细胞模型和动物模型上,或者虽然已开展人体临床试验,但是仍然停留在I期或II期临床试验阶段,参与临床试验的患者人数仍然偏少,仍需通过招募更多的患者人数来开展III期临床试验。因此,最终能否得到各国监管机构的批准,仍是未知数。去年,美国FDA批准了两种CAR - T细胞产品上市——诺华公司(Novartis)的CAR-T细胞免疫疗法Kymriah(tisagenlecleucel,CTL-019)和Kite制药公司的CAR-T细胞免疫疗法Yescarta(axicabtagene ciloleucel),分别用于治疗儿童和年轻人B细胞急性淋巴细胞白血病(ALL)和成人复发或难治性大B细胞淋巴瘤患者。然而,CAR-T细胞免疫疗法尽管在治疗血液肿瘤中有巨大的希望,但是同时也存在较大的副作用。CAR-T细胞免疫疗法带来一个巨大的临床风险就是细胞因子风暴。当CAR-T细胞快速杀死癌细胞时,产生的大量细胞因子会对宿主其他组织器官发起惊人的攻击,导致高烧、低压、休克甚至死亡。此外,血液肿瘤仅是癌症中的一小部分。作为癌症中的大头,实体瘤远比血液肿瘤复杂得多。尽管初步研究已表明CAR-T细胞免疫疗法在实体瘤方面具有不错的安全性和有效性,但是接受治疗的患者也会出现败血症、气短和白细胞水平升高等副作用,对实体瘤的治疗似乎并没有想象中的那么乐观。不过,在未来,随着科学家们不断取得新的突破,诸如CAR - T细胞疗法之类的细胞疗法有望为更多患者带来福音。
参考文献:
1. Katherine A. Freitas et al. Enhanced T cell effector activity by targeting the Mediator kinase module. Science, 2022, doi:10.1126/science.abn5647.
2. Daniel B. Goodman et al. Pooled screening of CAR T cells identifies diverse immune signaling domains for next-generation immunotherapies. Science Translational Medicine, 2022, doi:10.1126/scitranslmed.abm1463.
3. Giorgio Ottaviano et al. Phase 1 clinical trial of CRISPR-engineered CAR19 universal T cells for treatment of children with refractory B cell leukemia, Science Translational Medicine, 2022, doi:10.1126/scitranslmed.abq3010.
4. Susan P. Foy et al. Non-viral precision T cell receptor replacement for personalized cell therapy, Nature, 2022, doi:10.1038/s41586-022-05531-1.
5. Sham Mailankody et al. GPRC5D-Targeted CAR T Cells for Myeloma. NEJM, 2022, doi:10.1056/NEJMoa2209900.
6. Ye Li et al. KIR-based inhibitory CARs overcome CAR-NK cell trogocytosis-mediated fratricide and tumor escape. Nature Medicine, 2022, doi:10.1038/s41591-022-02003-x.
7. Jiqin Zhang et al. Non-viral, specifically targeted CAR-T cells achieve high safety and efficacy in B-NHL. Nature, 2022, doi:10.1038/s41586-022-05140-y.
8. Julia Carnevale et al. RASA2 ablation in T cells boosts antigen sensitivity and long-term function. Nature, 2022, doi:10.1038/s41586-022-05126-w.
9. Chen Chen et al. Intracavity generation of glioma stem cell–specific CAR macrophages primes locoregional immunity for postoperative glioblastoma therapy. Science Translational Medicine, 2022, doi:10.1126/scitranslmed.abn1128.
10. Abdullah Freiwan et al. Engineering Naturally Occurring CD7 Negative T Cells for the Immunotherapy of Hematological Malignancies. Blood, 2022, doi:10.1182/blood.2021015020.
11. Ran Jinget al. EZH1 repression generates mature iPSC-derived CAR T cells with enhanced antitumor activity. Cell Stem Cell, 2022, doi:10.1016/j.stem.2022.06.014.
12. Ao Guo et al. cBAF complex components and MYC cooperate early in CD8+ T cell fate. Nature, 2022, doi:10.1038/s41586-022-04849-0.
13. Rebecca C. Larson et al. CAR T cell killing requires the IFNγR pathway in solid but not liquid tumours. Nature, 2022, doi:10.1038/s41586-022-04585-5.
14. Louai Labanieh et al. Enhanced safety and efficacy of protease-regulated CAR-T cell receptors. Cell, 2022, doi:10.1016/j.cell.2022.03.041.
15. Rom Leidner et al. Neoantigen T-Cell Receptor Gene Therapy in Pancreatic Cancer. New England Journal of Medicine, 2022, doi:10.1056/NEJMoa2119662.
16. Iowis Zhu et al. Modular design of synthetic receptors for programmed gene regulation in cell therapies. Cell, 2022, doi:10.1016/j.cell.2022.03.023.
17. Mateusz Legut et al. A genome-scale screen for synthetic drivers of T cell proliferation. Nature, 2022, doi:10.1038/s41586-022-04494-7.
18. J. Joseph Melenhorst et al. Decade-long leukemia remissions with persistence of CD4+ CAR T-cells. Nature, 2022, doi:10.1038/s41586-021-04390-6.
19. Joel Rurik et al. CAR T cells produced in vivo to treat cardiac injury. Science, 2022, doi:10.1126/science.abm0594.
20. Hui-Shan Li et al. High-performance multiplex drug-gated CAR circuits. Cancer Cell, 2022, doi:10.1016/j.ccell.2022.08.008.
21. Ningbo Zheng et al. Induction of tumor cell autosis by myxoma virus-infected CAR-T and TCR-T cells to overcome primary and acquired resistance. Cancer Cell, 2022, doi:10.1016/j.ccell.2022.08.001.
22. Gloria B. Kim et al. Quantitative immunopeptidomics reveals a tumor stroma–specific target for T cell therapy. Science Translational Medicine, 2022, doi:10.1126/scitranslmed.abo6135.
23. Abigail K. Grosskopf et al. Delivery of CAR-T cells in a transient injectable stimulatory hydrogel niche improves treatment of solid tumors. Science Advances, 2022, doi:10.1126/sciadv.abn8264.
24. Zhen Lu et al. ATF3 and CH25H regulate effector trogocytosis and anti-tumor activities of endogenous and immunotherapeutic cytotoxic T lymphocytes. Cell Metabolism, 2022, doi:10.1016/j.cmet.2022.08.007.
25. Anusha Kalbasi et al. Potentiating adoptive cell therapy using synthetic IL-9 receptors. Nature, 2022, doi:10.1038/s41586-022-04801-2.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


