Sci Rep揭秘甘草酸的神奇疗效:甘草酸通过抑制HMGB1减缓结直肠癌进程
来源:生物谷原创 2024-11-04 14:48
甘草酸(GL)能够通过抑制高迁移率组蛋白1(HMGB1)来调节非同源末端连接(NHEJ)通路,从而增强DNA损伤反应,进而有效抑制结直肠癌细胞的增殖,显示出癌症治疗潜力。
 结直肠癌(CRC)是全球癌症相关死亡的主要原因之一,其早期症状缺乏,往往导致晚期诊断,增加了治疗难度。尽管手术切除是局部肿瘤患者的首选治疗,但在远处转移的情况下,辅助化疗和放疗仍是主要治疗方式。然而,患者在接受这些治疗后,5年生存率仅约10%,这突显了现有治疗手段的局限性,亟需深入研究以寻找新的治疗靶点。
结直肠癌(CRC)是全球癌症相关死亡的主要原因之一,其早期症状缺乏,往往导致晚期诊断,增加了治疗难度。尽管手术切除是局部肿瘤患者的首选治疗,但在远处转移的情况下,辅助化疗和放疗仍是主要治疗方式。然而,患者在接受这些治疗后,5年生存率仅约10%,这突显了现有治疗手段的局限性,亟需深入研究以寻找新的治疗靶点。
DNA损伤反应(DDR)在维持基因组稳定性中至关重要,CRC通常由良性病变发展而来,伴随DNA损伤的累积。高迁移率组蛋白1(HMGB1)在DNA修复和肿瘤发生中发挥重要作用,促进非同源末端连接(NHEJ)修复双链断裂。抑制HMGB1可能增强癌细胞对放疗和化疗的敏感性。甘草酸(GL)作为HMGB1的抑制剂,具备抗氧化、抗炎和抗癌等多种效果。近日,滨州医科大学马延超研究团队在Sci Rep发表了题为Glycyrrhizin ameliorates colorectal cancer progression by regulating NHEJ pathway through inhibiting HMGB1-induced DNA damage response的研究论文,发现GL能够通过抑制HMGB1来调节NHEJ通路,从而增强DNA损伤反应,进而有效抑制结直肠癌细胞的增殖,显示出癌症治疗潜力。

GL在体外有效抑制CRC细胞增殖
对HT29和HCT116细胞进行不同浓度的GL处理后,使用CCK-8法评估细胞活力,结果表明GL以剂量依赖方式抑制细胞活力,其半数抑制浓度(IC50)分别为267.3 µM和258.3 µM,最终选择300 µM用于后续实验。克隆形成实验结果显示,GL处理后CRC细胞的克隆数显著减少。流式细胞术分析表明,GL处理显著增加了细胞凋亡比例,并增强了半胱天冬酶-3的活性和蛋白水平。同时,细胞周期分析显示GL处理后CRC细胞S期比例显著上升。Western blotting结果表明,GL诱导了cyclin D1的表达,而对CDK2无明显影响。这些发现表明,GL有效抑制了CRC细胞的增殖。
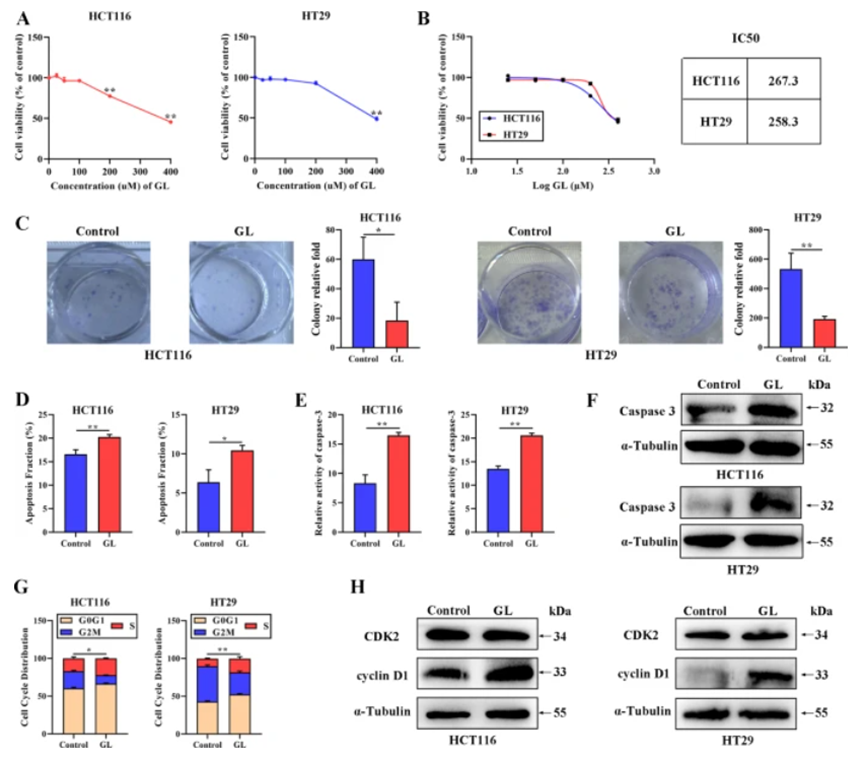
图1:GL对CRC细胞的影响
GL处理通过抑制NHEJ通路加速DDR
研究发现,GL处理后,γH2A.x焦点数量在0.25小时至2小时内显著增加,随后逐渐减少,且磷酸化γH2A.x的蛋白水平显著上升。此外,彗星实验结果显示,GL处理显著阻碍了DNA修复能力,同时8-OHdG的产生也显著增加,这与DNA损伤相关的癌变过程密切相关。实时定量PCR分析显示,GL处理后与NHEJ通路相关的基因Ku70、Ku80和XRCC4的表达显著降低,Western blotting进一步证实了Ku70和LIG4的蛋白水平显著减少。这些结果表明,GL处理通过抑制NHEJ通路加速了CRC细胞的DDR。
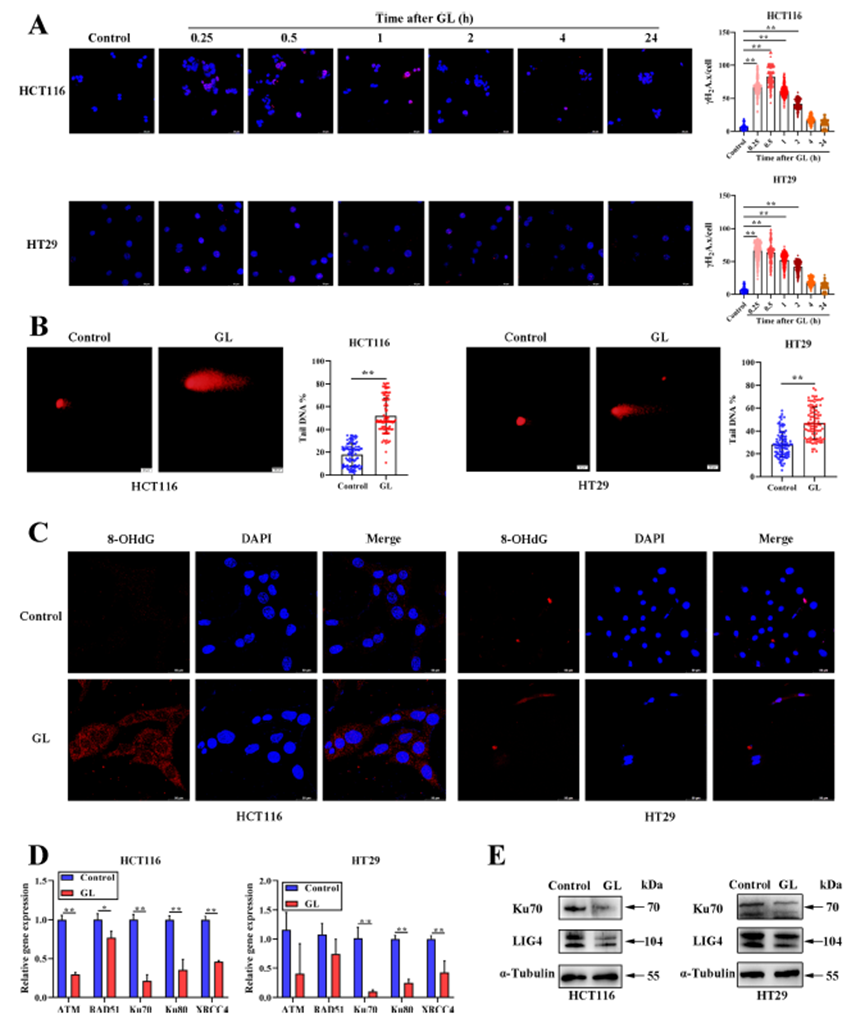
图2:GL对CRC细胞DNA损伤的影响
GL有效抑制了CRC进展
将Balb/c小鼠接种CT26异种移植物后,给予15 mg/kg的GL治疗,结果显示,与对照组相比,GL显著抑制了CT26异种移植物的生长,同时对肿瘤重量没有显著影响。免疫组化染色结果表明,GL处理显著减少了肿瘤组织中Ki67阳性细胞的数量。TUNEL实验显示,GL治疗增加了异种移植物组织中的凋亡细胞数量。此外,γH2A.x焦点形成的免疫组化结果也显示,GL处理明显增强了γH2A.x焦点的形成。这些数据表明,GL通过激活DNA损伤反应抑制了CRC细胞增殖。
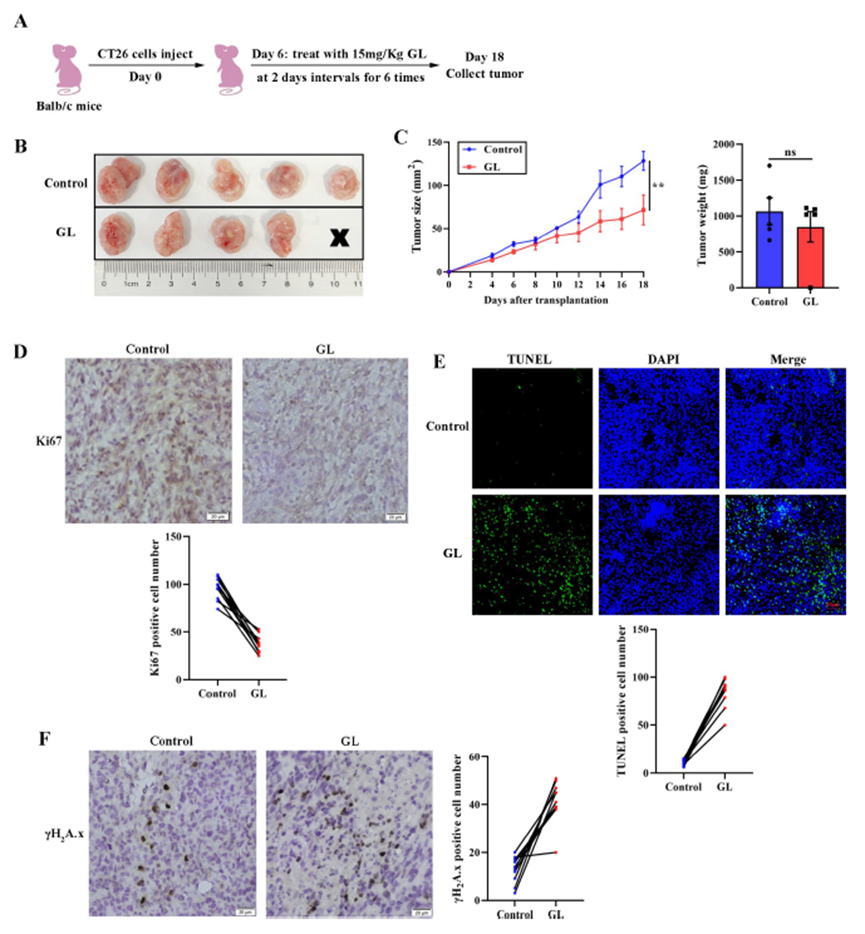
图3:GL抑制了体内CRC细胞增殖
GL通过抑制HMGB1影响CRC细胞增殖
研究显示,GL处理后CRC细胞中的HMGB1蛋白水平显著降低,而HMGB1的过表达则能够逆转GL的抑制效应。在HMGB1过表达的CRC细胞中,GL处理后细胞活力和克隆形成能力明显恢复,同时凋亡细胞比例降低。HMGB1的过表达还减少了GL处理后半胱天冬酶-3的活性及蛋白水平,并降低了S期细胞的比例。此外,HMGB1过表达逆转了GL诱导的cyclin D1蛋白水平上升。这些结果表明,GL通过调节HMGB1的表达来减缓CRC的进展。
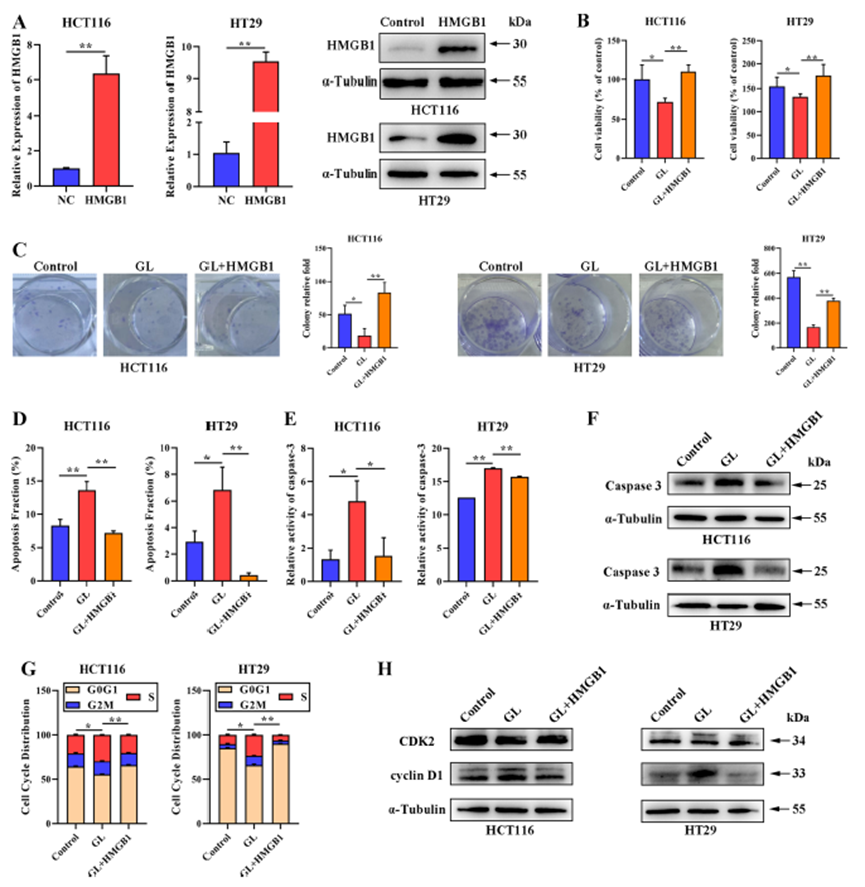
图4:GL通过抑制HMGB1影响减轻CRC细胞增殖
GL通过抑制HMGB1调节NHEJ通路而增强DDR
研究发现,在GL处理后,HMGB1的过表达显著降低了CRC细胞中的γH2A.x焦点形成,并显著提高了磷酸化γH2A.x的蛋白水平。此外,HMGB1的过表达还减少了CRC细胞中DNA尾部百分比,并降低了8-OHdG的产生。同时,HMGB1过表达逆转了GL处理所导致的Ku70和LIG4蛋白水平下降。这些结果表明,GL通过HMGB1依赖性机制调节NHEJ通路,从而促进DNA损伤反应。
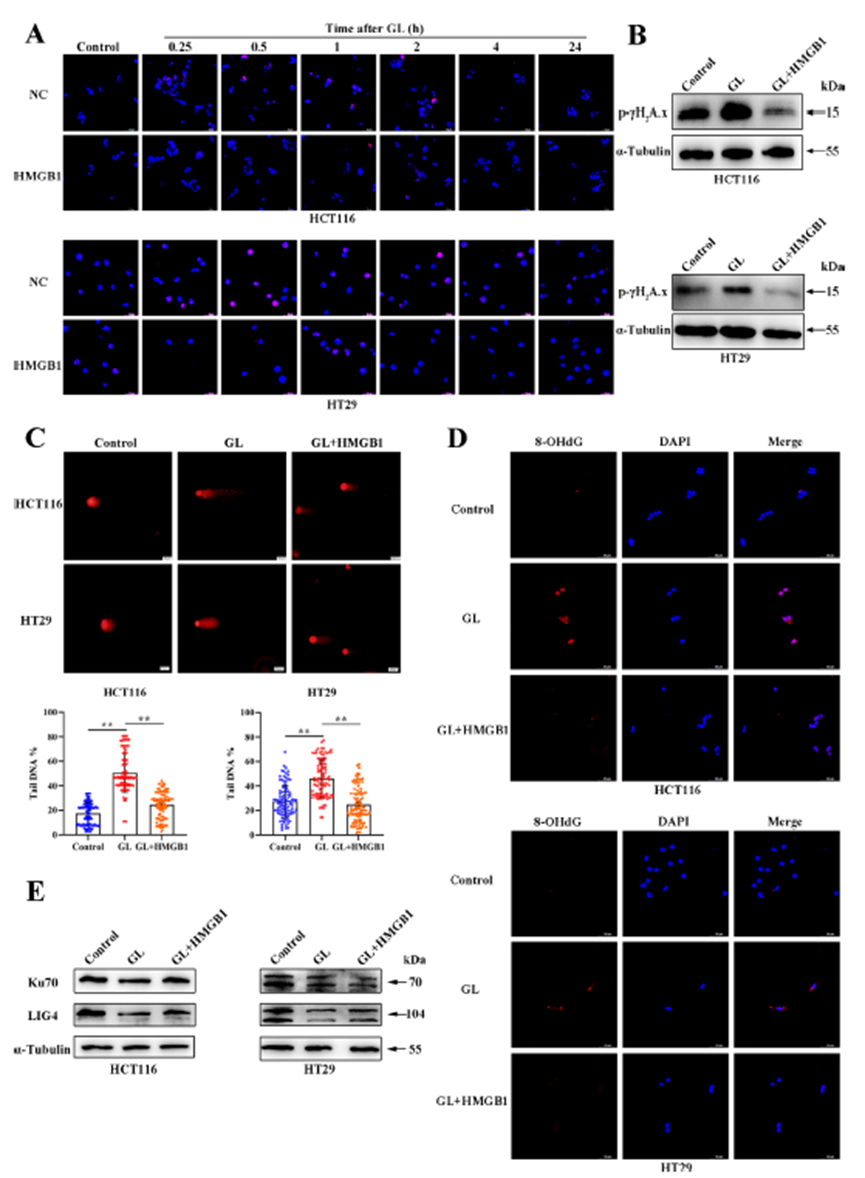
图5:GL通过抑制HMGB1调节NHEJ通路而增强DDR
HMGB1的异常表达与CRC组织样本的总生存率相关
研究分析了80例人类CRC及其匹配的正常邻近组织,结果显示CRC组织中的HMGB1表达显著高于正常组织,并且HMGB1呈现核染色。此外,HMGB1的表达随着肿瘤阶段的增加而上升,临床晚期(III和IV期)的HMGB1水平明显高于早期(I和II期)。Kaplan-Meier分析表明,低HMGB1表达的患者整体生存期显著长于高HMGB1表达的患者。这些结果表明,高HMGB1表达可能是CRC患者不良临床预后的潜在指标。
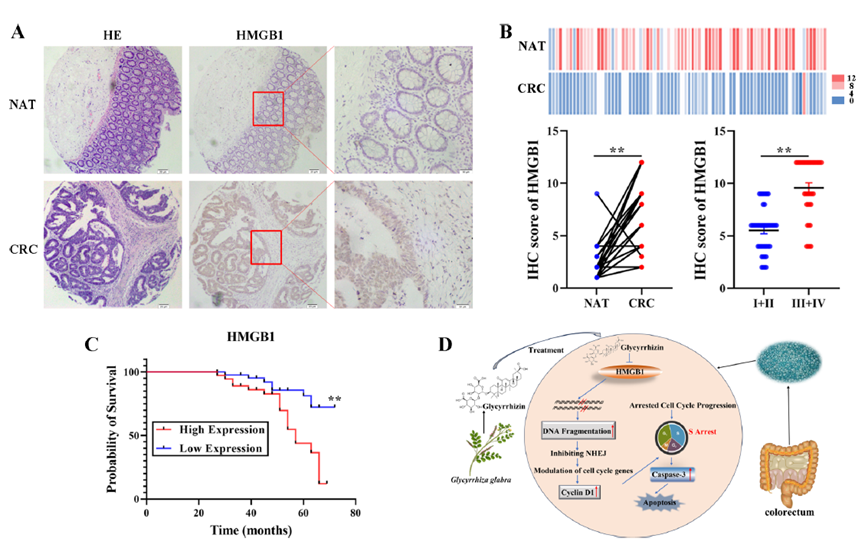
图6:GL通过HMGB1依赖机制减缓CRC进程
总体而言,本研究探讨了甘草酸(GL)在结直肠癌(CRC)中的作用,发现GL通过抑制高迁移率组蛋白1(HMGB1)来增强DNA损伤反应(DDR),从而抑制CRC细胞增殖。实验表明,GL显著诱导细胞凋亡和阻滞S期细胞周期,增加了γH2A.x焦点和8-OHdG的形成,增强了DNA损伤反应。HMGB1的过表达逆转了GL引起的细胞凋亡和DNA损伤反应,且在CRC组织中HMGB1的异常表达与肿瘤分期及预后相关。结果表明,GL通过HMGB1依赖机制减缓CRC进程,显示出癌症治疗潜力。(生物谷Bioon.com)
参考文献:
Han, Y., Sheng, W., Liu, X. et al. Glycyrrhizin ameliorates colorectal cancer progression by regulating NHEJ pathway through inhibiting HMGB1-induced DNA damage response. Sci Rep 14, 24948 (2024). https://doi.org/10.1038/s41598-024-76155-w
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


