Science:揭示小鼠胚胎的发育时钟和从头细胞极化机制
来源:本站原创 2020-12-16 10:17
2020年12月16日讯/生物谷BIOON/---在植入前发育的过程中,顶-底细胞极性(apicobasal cell polarity)的建立是从全能性向多能性过渡的关键,从而诱导细胞向滋养外胚层(trophectoderm)分化。在小鼠胚胎中,这一事件被设定在8个细胞阶段发生,这一时间遵循一种内在的发育时钟,与胚胎大小或细胞周期进展无关。尽管顶端区域(a
2020年12月16日讯/生物谷BIOON/---在植入前发育的过程中,顶-底细胞极性(apicobasal cell polarity)的建立是从全能性向多能性过渡的关键,从而诱导细胞向滋养外胚层(trophectoderm)分化。在小鼠胚胎中,这一事件被设定在8个细胞阶段发生,这一时间遵循一种内在的发育时钟,与胚胎大小或细胞周期进展无关。尽管顶端区域(apical domain)的形成非常重要,但在小鼠和人类胚胎中,建立细胞极化和对这一事件进行时间调控的分子机制在很大程度上仍然是未知的。
在不同的哺乳动物物种中,合子基因组激活(zygotic genome activation, ZGA)在进化上保守地发生在细胞极化建立之前。因此,在一项新的研究中,来自英国剑桥大学、美国加州理工学院和中国清华大学的研究人员假设合子转录调控细胞极化的时间。
为了验证这一点,这些作者使用了分析方法来改变合子转录本在细胞中的浓度,并评估这些变化对胚胎极化时间的影响。他们还对124种合子表达的转录本进行了RNA干扰(RNAi)筛选,以确定对细胞极化至关重要的合子转录本的分子身份。最后,他们结合前沿的成像方法与生物物理建模,以解释他们鉴定出的合子转录本如何调节细胞极化的从头建立。相关研究结果发表在2020年12月11日的Science期刊上,论文标题为“Developmental clock and mechanism of de novo polarization of the mouse embryo”。
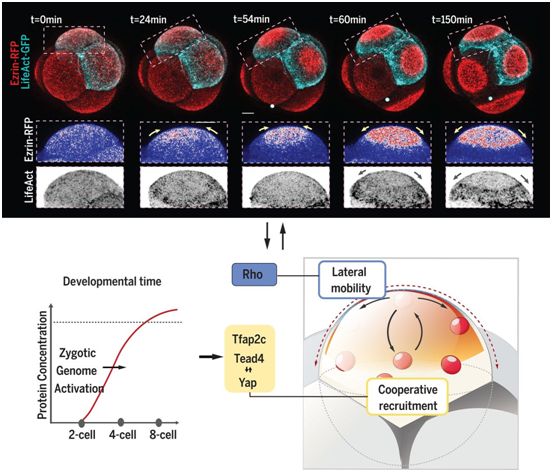
小鼠胚胎中细胞极性的特点是出现一个帽形的顶端区域。与这些作者提出的假说相一致的是,合子转录本的增加或减少分别加速或抑制顶端区域的形成。他们的RNAi筛选发现了两种转录因子--转录因子AP-2γ(Tfap2c)和TEA结构域转录因子4(Tead4),这两个转录因子在调控细胞极化时间方面起着冗余的作用。
Tfap2c和Tead4蛋白都在ZGA后积累,它们的表达升高使得极性蛋白在四细胞阶段过早地锚定到顶端表面。然而,这些顶端蛋白未能组装成扩大的顶端区域,而是变得超中心化,形成膜突起。这表明,顶端区域的形成需要一个额外的条件。这些作者之前已经描述了Rho鸟苷三磷酸酶(GTPase)信号,它调节肌动蛋白的顶端定位,并在八细胞阶段左右被激活,对细胞极性的建立非常重要。
在这项新的研究中,这些作者发现Rho GTPase的过早激活与Tfap2c和Tead4的表达,过早地诱导出完整的顶端区域,从而导致滋养外胚层转录因子的过早表达,并导致细胞极化下游的形态发生事件。
通过结合定量成像测量和数学建模,这些作者发现,顶端区域的形成是由两个关键过程之间的动态相互作用驱动的:(i)蛋白ezrin通过肌动蛋白网络的合作招募和(ii)蛋白ezrin在膜上的侧向移动性。在这些相互作用的实验证据和生物物理模拟的基础上,他们证实Tfap2c和Tead4控制ezrin的合作招募,而RhoA促进膜流动性。
细胞极化的时间和机制在很大程度上仍然未知。这些作者如今鉴定出小鼠胚胎中细胞极化的从头建立所必需的分子。这些研究结果表明,ZGA在调节细胞极化的时间方面发挥了直接作用。除了鉴定出足以建立细胞极化的关键分子外,他们还从生物物理学角度了解了这些分子在哺乳动物胚胎中建立细胞极化的机制。(生物谷 Bioon.com)
参考资料:
Meng Zhu et al. Developmental clock and mechanism of de novo polarization of the mouse embryo. Science, 2020, doi:10.1126/science.abd2703.
在不同的哺乳动物物种中,合子基因组激活(zygotic genome activation, ZGA)在进化上保守地发生在细胞极化建立之前。因此,在一项新的研究中,来自英国剑桥大学、美国加州理工学院和中国清华大学的研究人员假设合子转录调控细胞极化的时间。
为了验证这一点,这些作者使用了分析方法来改变合子转录本在细胞中的浓度,并评估这些变化对胚胎极化时间的影响。他们还对124种合子表达的转录本进行了RNA干扰(RNAi)筛选,以确定对细胞极化至关重要的合子转录本的分子身份。最后,他们结合前沿的成像方法与生物物理建模,以解释他们鉴定出的合子转录本如何调节细胞极化的从头建立。相关研究结果发表在2020年12月11日的Science期刊上,论文标题为“Developmental clock and mechanism of de novo polarization of the mouse embryo”。

顶端区域形成的分子机制和时间调控,图片来自Science, 2020, doi:10.1126/science.abd2703。
小鼠胚胎中细胞极性的特点是出现一个帽形的顶端区域。与这些作者提出的假说相一致的是,合子转录本的增加或减少分别加速或抑制顶端区域的形成。他们的RNAi筛选发现了两种转录因子--转录因子AP-2γ(Tfap2c)和TEA结构域转录因子4(Tead4),这两个转录因子在调控细胞极化时间方面起着冗余的作用。
Tfap2c和Tead4蛋白都在ZGA后积累,它们的表达升高使得极性蛋白在四细胞阶段过早地锚定到顶端表面。然而,这些顶端蛋白未能组装成扩大的顶端区域,而是变得超中心化,形成膜突起。这表明,顶端区域的形成需要一个额外的条件。这些作者之前已经描述了Rho鸟苷三磷酸酶(GTPase)信号,它调节肌动蛋白的顶端定位,并在八细胞阶段左右被激活,对细胞极性的建立非常重要。
在这项新的研究中,这些作者发现Rho GTPase的过早激活与Tfap2c和Tead4的表达,过早地诱导出完整的顶端区域,从而导致滋养外胚层转录因子的过早表达,并导致细胞极化下游的形态发生事件。
通过结合定量成像测量和数学建模,这些作者发现,顶端区域的形成是由两个关键过程之间的动态相互作用驱动的:(i)蛋白ezrin通过肌动蛋白网络的合作招募和(ii)蛋白ezrin在膜上的侧向移动性。在这些相互作用的实验证据和生物物理模拟的基础上,他们证实Tfap2c和Tead4控制ezrin的合作招募,而RhoA促进膜流动性。
细胞极化的时间和机制在很大程度上仍然未知。这些作者如今鉴定出小鼠胚胎中细胞极化的从头建立所必需的分子。这些研究结果表明,ZGA在调节细胞极化的时间方面发挥了直接作用。除了鉴定出足以建立细胞极化的关键分子外,他们还从生物物理学角度了解了这些分子在哺乳动物胚胎中建立细胞极化的机制。(生物谷 Bioon.com)
参考资料:
Meng Zhu et al. Developmental clock and mechanism of de novo polarization of the mouse embryo. Science, 2020, doi:10.1126/science.abd2703.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


