研究揭示谷胱甘肽化修饰调控Hsp70功能的机制
来源:生物物理所 2020-08-11 12:29
蛋白质半胱氨酸Cys上的谷胱甘肽化修饰作为一种可逆的氧化还原修饰,一方面可以保护蛋白免于发生磺酸化(-SO3H)等不可逆的氧化损伤,另一方面和磷酸化修饰一样发挥信号转导功能,传递氧化还原信号。Hsp70是蛋白质质量控制体系中的核心分子伴侣,对于生命体稳态平衡有极为重要的意义。除极少数Hsp70之外,大部分Hsp70都有至少1个Cys。深入挖掘Hs
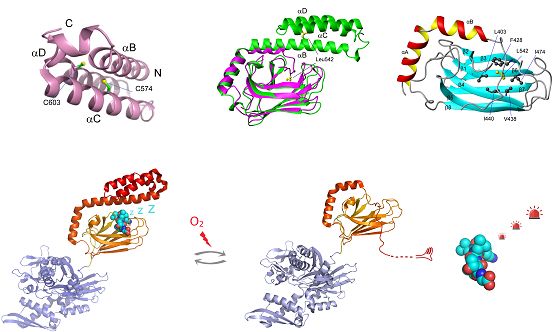
蛋白质半胱氨酸Cys上的谷胱甘肽化修饰作为一种可逆的氧化还原修饰,一方面可以保护蛋白免于发生磺酸化(-SO3H)等不可逆的氧化损伤,另一方面和磷酸化修饰一样发挥信号转导功能,传递氧化还原信号。Hsp70是蛋白质质量控制体系中的核心分子伴侣,对于生命体稳态平衡有极为重要的意义。除极少数Hsp70之外,大部分Hsp70都有至少1个Cys。深入挖掘Hsp70的氧化还原修饰机制,对帮助揭示蛋白质稳态的氧化还原调控机制及拓展对Hsp70功能的认识具有意义。
近日,中国科学院生物物理研究所柯莎研究组、陈畅研究组合作,发现人源应激型Hsp70的C末端底物结合域的α螺旋盖子上的两个半胱氨酸发生谷胱甘肽化修饰后,导致其C末端α螺旋盖子发生去折叠,从而暴露Leu542,该残基与底物结合域的相互作用导致了Hsp70底物结合部位的封闭,而不能结合其底物,这一过程随去谷胱甘肽化的发生而完全可逆。研究结果揭示了Hsp70的谷胱甘肽化修饰对其结构和功能的调控机制,阐明了人源应激型Hsp70的C端结构域上的谷胱甘肽化修饰,是一种调节Hsp70底物结合能力的新机制,可能在氧化应激时调节其底物的活性,从而传递氧化还原信号。 (生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


