科研人员研发新型“二合一”猴痘病毒重组蛋白疫苗
来源:网络 2024-01-16 15:47
猴痘病毒在非洲中西部长期局部流行,且近年来其外溢出非洲的感染事件愈发频繁、感染波及范围愈发广泛,并出现与HIV感染重叠流行的趋势,防控形势严峻。
北京大学未来技术学院王寒副研究员团队与中国科学院微生物研究所高福团队合作在Nature Immunology期刊上发表题为“Rational design of a ‘two-in-one’ immunogen DAM drives potent immune response against monkeypox virus”的研究论文。该研究通过抗原结构指导的多表位嵌合策略,创新性地设计了一款“二合一”的猴痘病毒重组蛋白疫苗——DAM,实现单一免疫原对猴痘病毒两种感染性病毒粒子的全面保护,其对猴痘病毒的中和能力是传统减毒活疫苗的28倍,为猴痘病毒的防控提供了更为安全和可规模化的替代性疫苗方案。
猴痘病毒在非洲中西部长期局部流行,且近年来其外溢出非洲的感染事件愈发频繁、感染波及范围愈发广泛,并出现与HIV感染重叠流行的趋势,防控形势严峻。目前,全球获批(紧急使用)的猴痘疫苗均为针对天花病毒研发的活病毒疫苗,存在明确副作用,接种人群受限。然而,由于猴痘病毒的感染形式多样(具有两种感染性病毒粒子:IMV和EEV)且免疫原成分复杂,单一免疫原无法提供高效保护;而多免疫原混合免疫则无法避免免疫原之间生物利用度的差异,进而影响疫苗效果的稳定性,并提高的工业化成本和复杂性,极大地限制了新型疫苗的研发。
为解决上述问题,研究团队首先对IMV和EEV各自的关键抗原M1和A35作免疫原性评估。研究发现EEV抗原A35通过近膜端的颈部区(stalk region)上的二硫键二聚化,其中和表位就位于远膜端的二聚化界面,而A35颈部区是其免疫原性强弱的决定性因素。为了在提高A35免疫原性并稳定其中和表位的同时,获得更加均一的A35抗原,研究团队去除了其颈部区二硫键,并利用颈部区序列对A35进行单肽链二聚化改造,获得了单链A35二聚体。在此基础上,研究团队基于抗原的三维结构,将两个IMV抗原M1与单链A35二聚体作单肽链嵌合改造,设计出了兼顾两种感染性病毒粒子的全新猴痘单一免疫原DAM(DoubleA35 and M1)。

图1. DAM疫苗设计方案
团队在小鼠模型上对DAM疫苗的免疫原性、保护效果和安全性进行评估。结果表明,DAM疫苗具有极好的免疫原性,其激发的M1和A35特异性抗体水平均高于两种抗原混合免疫。DAM疫苗激发的猴痘病毒中和抗体水平远高于传统的活病毒疫苗,达到了后者的28倍。同时,DAM疫苗实现了对致死剂量痘苗病毒感染小鼠的完全保护并表现出极高的安全性。研究团队与上海君实生物合作,开发了DAM工业级生产细胞株和一步纯化法,在小试阶段产量达到g/L级别,表明其具有极大的生产放大潜能。
总的来说,该研究为研发更为安全的下一代猴痘病毒疫苗提供了新思路和解决方案。
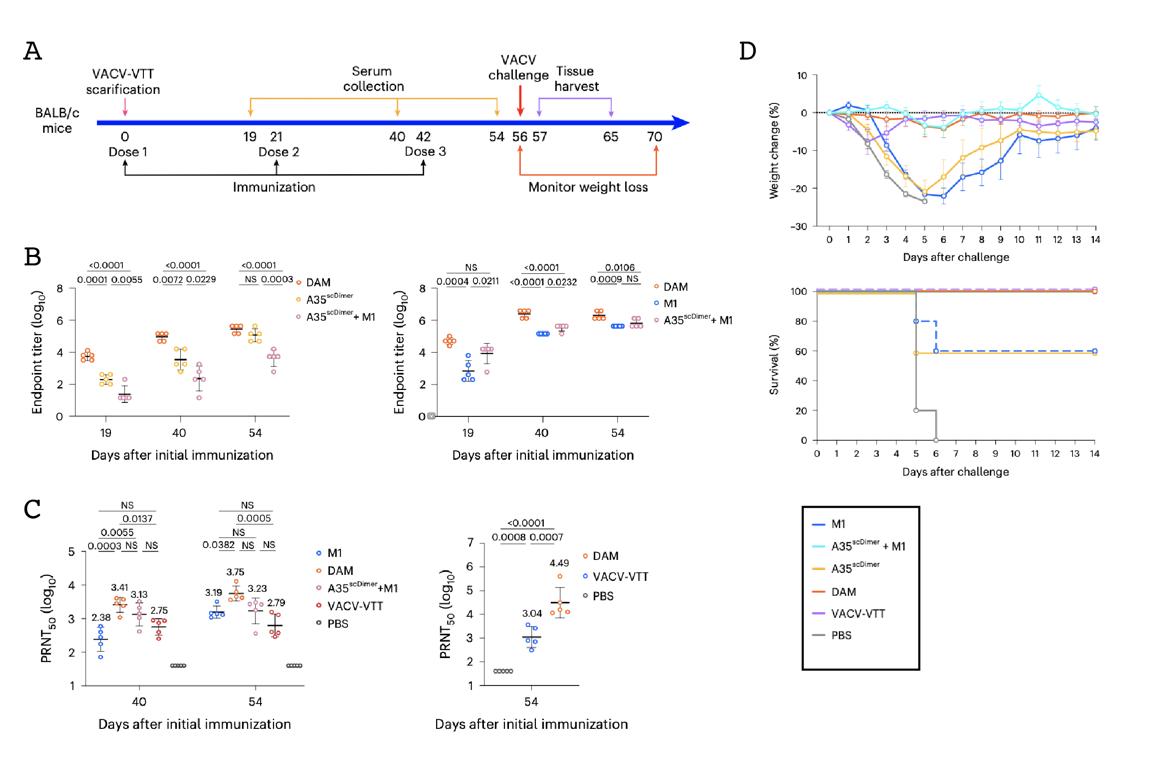
图2. DAM疫苗效果评价
王寒为论文的第一作者和通信作者,中国科学院微生物研究所高福研究员、王奇慧研究员以及中国疾控中心病毒病研究所谭文杰研究员为论文的共同通信作者,北京航空航天大学的尹朋副教授、中国科学院微生物研究所副研究员李世华、博士研究生郑婷婷和辽宁大学硕士研究生覃兰菊为论文的共同第一作者。中国科学院微生物所方敏研究员、北京大学席建忠教授、中国生物杨晓明博士和段凯博士等对本课题给予了大力支持。本项目得到了国家自然科学基金、科技部重点研发计划以及北京大学学科建设项目的经费支持。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


