Cancer Cell:邹伟平团队揭示衣康酸转运蛋白SLC13A3赋予肿瘤铁死亡抗性,削弱肿瘤免疫治疗效果
来源:生物世界 2024-11-19 13:32
该研究确定了肿瘤和肿瘤相关巨噬细胞(TAM)之间通过SLC13A3-衣康酸-NRF2-SLC7A11信号轴的相互作用。
密歇根大学邹伟平教授团队在 Cancer Cell 期刊发表了题为:Itaconate transporter SLC13A3 impairs tumor immunity via endowing ferroptosis resistance 的研究论文。
该研究发现,肿瘤中SLC13A3表达水平与免疫检查点阻断(ICB)疗效和患者生存相关。SLC13A3是肿瘤中衣康酸的转运蛋白,肿瘤相关巨噬细胞(TAM)来源的衣康酸赋予了肿瘤抵抗铁死亡和进展能力,而SLC13A3抑制剂增强肿瘤铁死亡并促进了ICB耐药性肿瘤的治疗效果。

有400多种溶质载体家族(SLC)转运多种代谢底物。最近的研究开始阐明葡萄糖转运体(例如SLC2A1和SLC2A4)和氨基酸转运体(例如SLC7A11和SLC43A2)在T细胞介导的肿瘤免疫中的重要性。
然而,包括SLC13在内的大多数SLC家族成员在肿瘤免疫应答和免疫治疗方面的研究还很不足。在SLC13家族的5个成员中,SLC13A1和SLC13A4可能是无机硫酸盐的转运蛋白,而SLC13A2、SLC13A3和SLC13A5被认为是二羧酸盐和三羧酸盐的转运蛋白。但SLC13成员的表达模式、免疫学意义以及在TME中转运癌症代谢物(例如衣康酸)的潜在作用尚不明确。
衣康酸(Itaconate)是三羧酸循环(TCA)中产生的代谢产物,由IRG1基因编码的代谢酶乌头酸脱羧酶1 (ACOD1)催化。在炎症反应过程中,IRG1表达上调,导致ACOD1表达增加,促进顺乌头酸向衣康酸的转化。内源性衣康酸在炎症反应中发挥免疫调节作用,尤其是在细菌感染中。
然而,在肿瘤微环境(TME)中,肿瘤细胞是否以及如何摄取细胞外的衣康酸,以及衣康酸是否对免疫检查点阻断(ICB)引发的肿瘤细胞死亡有直接作用,目前尚不清楚。
铁死亡(Ferroptosis)是一种由铁、活性氧和细胞膜脂质过氧化驱动的受控细胞死亡形式。免疫检查点阻断(ICB)激活的T细胞源性干扰素γ(IFNγ)结合特定脂肪酸作为内源性铁死亡诱导剂,诱导肿瘤细胞铁死亡,有助于ICB的疗效。诱导肿瘤细胞铁死亡是细胞毒性CD8+ T细胞的一种作用方式,也是ICB的潜在机制。鉴于大多数患者对ICB疗法无应答,研究团队推测,肿瘤微环境(TME)中可能存在能够抑制肿瘤细胞铁死亡的内源性机制或因子,从而通过铁死亡抵抗实现肿瘤免疫逃逸。
在这项最新研究中,研究团队分析了肿瘤微环境(TME)中肿瘤相关巨噬细胞(TAM)与肿瘤细胞之间的相互作用,发现SLC13A3在肿瘤细胞中是衣康酸的转运体,并且在肿瘤对铁死亡和免疫检查点阻断(ICB)的抵抗中发挥了此前未被认识到的作用。
具体来说,该研究发现,SLC13A3是肿瘤细胞中的衣康酸转运蛋白,并赋予肿瘤铁死亡抵抗,降低肿瘤免疫和免疫检查点阻断(ICB)的疗效。从机制上来说,肿瘤细胞通过SLC13A3从肿瘤相关巨噬细胞(TAM)摄取衣康酸,从而激活NRF2-SLC7A11通路,逃逸免疫介导的铁死亡。
研究团队通过结构建模和分子对接分析确定了SLC13A3的功能性抑制剂——SLC13A3i。该研究进一步证实,巨噬细胞中ACOD1酶(衣康酸合成的必需酶)缺失、肿瘤中SLC13A3的敲除或SLC13A3i治疗,均可使肿瘤对铁死亡增敏,抑制肿瘤进展,并增强免疫检查点阻断(ICB)的疗效。
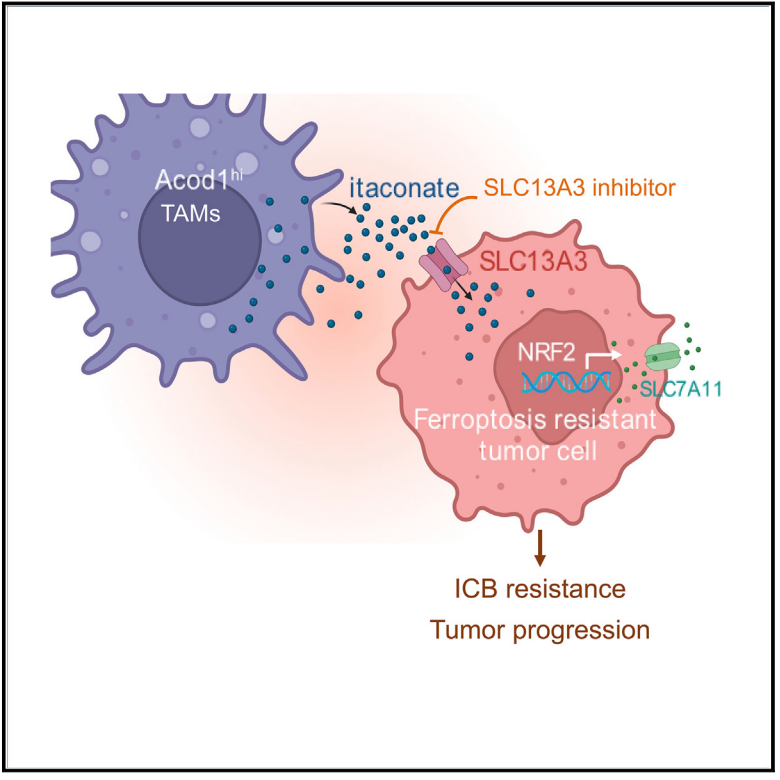
总的来说,该研究确定了肿瘤和肿瘤相关巨噬细胞(TAM)之间通过SLC13A3-衣康酸-NRF2-SLC7A11信号轴的相互作用,这是一种以前未知的、存在于肿瘤微环境(TME)中的免疫铁死亡抵抗机制。该研究还提示了SLC13A3有望作为治疗SLC13A3阳性癌症的有前途的免疫治疗靶点。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


