Lp(a)与大名鼎鼎的低密度脂蛋白胆固醇(LDL-C)的结构类似,由载脂蛋白(a)[apo(a)],与含有apo(b)的LDL样颗粒结合而成。其中,apo(a)正是问题的关键所在。
apo(a) 由基因LHA编码,在肝脏中合成。apo(a)可以通过抑制纤溶酶原激活促进血栓形成,此外还可以通过增加氧化磷脂促进炎症,诱导内皮功能障碍、加速动脉粥样硬化和斑块钙化。另一个组成部分,则像LDL-C一样,能够促进胆固醇沉积[1,2]。
另外,不同于其它血脂,Lp(a)水平主要由基因决定(80%-90%),不能通过传统的生活方式干预和他汀类药物治疗来改变[2]。
因此,Lp(a)被视为比低密度脂蛋白胆固醇(LDL-C)更恶毒的“坏”胆固醇,也被证明是动脉粥样硬化和主动脉瓣狭窄心血管疾病独立危险因素。
近日,心血管领域著名期刊《美国心脏病学会杂志》上发表的两篇论文基于队列研究结果,揭示出Lp(a)的更多“恶行”。


先来说说由美国约翰霍普金斯大学的João A.C. Lima等人完成的这项研究[4]。
心肌纤维化是导致心脏结构和功能重塑并引发心房颤动、心力衰竭的关键过程,分为为替代性纤维化(心肌瘢痕)和间质性纤维化。
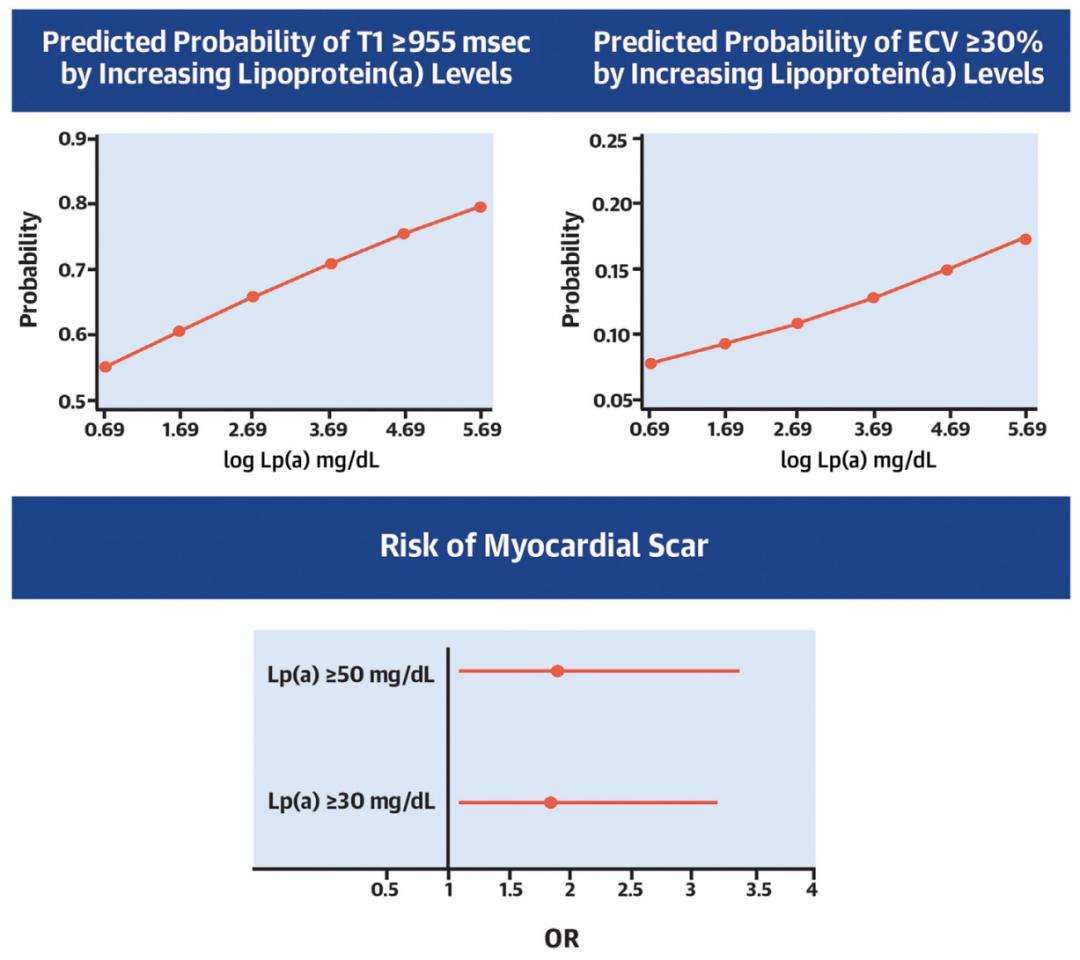
在这项研究中,研究者们基于一项名为MESA的研究队列,对2040名年龄在45-84岁之间的成年人的数据进行分析。研究人群平均年龄69岁,女性占48%,有15%为中国人。
间质性纤维化程度由心脏磁共振成像(CMR)得到的初始T1值(Native T1)和细胞外容积(ECV)进行评估,结果显示,Lp(a)水平升高与亚临床间质性心肌纤维化加剧相关。另一方面,心肌瘢痕也与Lp(a)脱不开关系,相比于Lp(a)较低水平,Lp(a)水平≥30mg/dL与心肌瘢痕风险显著增加85%相关(OR 1.85,95%CI 1.1-3.2;P=0.025),Lp(a)水平≥50mg/dL与心肌瘢痕风险增加90%相关(OR 1.9,95%CI 1.1-3.4;P=0.02)。
从心脏重塑来看,Lp(a)水平升高与左心室增大、舒张功能减退相关。
研究主要结果[4]
另一项研究由丹麦哥本哈根大学的Pia R. Kamstrup等人完成[3]。
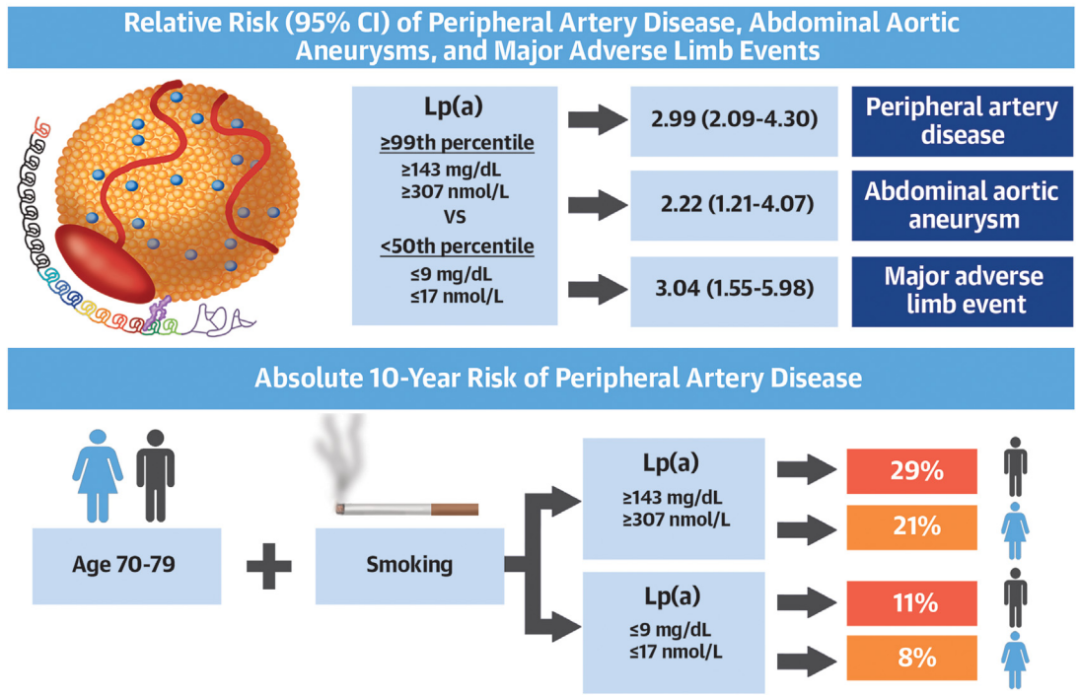
他们根据来自研究队列CGPS的108146名参与者的数据进行分析,发现Lp(a)水平较高与外周动脉疾病(PAD)、腹主动脉瘤(AA)和主要肢体不良事件(MALE)风险增加相关。
具体来看,在这个队列中,相比于Lp(a)水平较低(Lp(a)<50%,即≤9mg/dL或≤17nmol/L),Lp(a)水平较高(Lp(a)≥99%,即≥143mg/dL或≥307nmol/L)分别与外周动脉疾病风险、腹主动脉瘤风险增加199%、122%相关。对于患有外周动脉疾病的患者,Lp(a)水平较高与发生主要肢体不良事件风险增加204%相关。
Lp(a)每增加50mg/dL(105nmol/L),与外周动脉疾病和腹主动脉瘤风险分别增加约39%(HR 1.39,95%CI 1.24-1.56)和21%相关(HR 1.21,95%CI 1.01-1.44)。
不仅如此,研究还指出,对于年龄70-79岁的吸烟群体来说,Lp(a)水平较低和Lp(a)水平较高的女性外周动脉疾病的10年绝对风险为8%和21%,男性为11%和29%;女性腹主动脉瘤的10年绝对风险为2%和4%,男性为5%和12%。
研究主要结果[3]
总之,这两项研究进一步强调Lp(a)是一种新兴的疾病风险因素,除了动脉粥样硬化疾病,Lp(a)与其它疾病之间的关联也应该得到阐明。当然,谨慎一些的话,目前仍需要相关机制研究和其它队列以提供更多证据,正如克利夫兰诊所的Steven Nissen医学博士所点评[5],“尽管Lp(a)与心肌纤维化之间的联系很有趣,但其中的因果关系不明,我还是不会建议我的Lp(a)高水平患者去做心脏磁共振成像。”
悉数完Lp(a)的恶性,再来看一下现在我们手上主要有哪些应对策略。
其一,靶向apo(a)编码基因LHA的短干扰 RNA(siRNA)降脂药物,如lepodisiran、olpasiran、zerlasiran,通过限制apo(a)的合成来阻止Lp(a)的组装、降低其浓度。
其二 ,靶向LHA的反义寡核苷酸(ASO)降脂药物,如pelacarsen,同样是通过限制apo(a)的合成来发挥效果。
其三,这回咱不跟apo(a)的合成死磕了,转而通过阻断apo(a)与LDL样颗粒的结合来抑制Lp(a)的形成,比如小分子口服药物muvalaplin。
虽说目前市场上没有药物能够实实在在给Lp(a)个教训,但是近两年来,针对Lp(a)的降脂药物接二连三地公布不同阶段的临床试验结果,效果都很出色。以上这些药物有的以长效著称,有的以降脂幅度令人眼前一亮,有的则以口服为优势更胜一筹。
而对于临床上,Lp(a)指标背后还有哪些意义、检测方法如何标准化、临界点如何统一界定等问题,都有待科学家们继续探索[6]。尽管由于很大程度上由遗传因素决定,Lp(a)是一种无法通过生活方式就能简单对付的血脂蛋白,但同时也意味着这个疾病风险因子可以通过筛查识别高危人群以进行预防[6]。Lp(a)是否会掀起前沿研究领域的热潮,我们拭目以待。
参考文献:
[1]Banerjee R, Weideman S, Fernandez-Vazquez D,Banerjee A, Hasan A, Tsai S. Role of lipoprotein A
in lower extremity peripheral artery disease. Am J Cardiol. 2023;198:47–49.
[2]Wilson DP, Jacobson TA, Jones PH, et al. Use of lipoprotein(a) in clinical practice: a biomarker whose time has come. A scientific statement from the National Lipid Association. J Clin Lipidol.2022;16:e77–e95.
[3]Thomas, P. E., Vedel-Krogh, S., Nielsen, S. F., Nordestgaard, B. G., & Kamstrup, P. R. (2023). Lipoprotein(a) and Risks of Peripheral Artery Disease, Abdominal Aortic Aneurysm, and Major Adverse Limb Events. Journal of the American College of Cardiology, 82(24), 2265–2276. https://doi.org/10.1016/j.jacc.2023.10.009
[4]Chehab, O., Abdollahi, A., Whelton, S. P., Wu, C. O., Ambale-Venkatesh, B., Post, W. S., Bluemke, D. A., Tsai, M. Y., & Lima, J. A. C. (2023). Association of Lipoprotein(a) Levels With Myocardial Fibrosis in the Multi-Ethnic Study of Atherosclerosis. Journal of the American College of Cardiology, 82(24), 2280–2291. https://doi.org/10.1016/j.jacc.2023.10.016
[5]https://www.tctmd.com/news/lpa-appears-tied-myocardial-fibrosis-observational-data
[6]Beckman, J. A., & Sullivan, A. E. (2023). Lipoprotein(a), Peripheral Artery Disease, and Abdominal Aortic Aneurysm: The Next Frontier or Another Risk Enhancer?. Journal of the American College of Cardiology, 82(24), 2277–2279. https://doi.org/10.1016/j.jacc.2023.10.015
版权声明
本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。






