Nature Biotechnology:李大力团队等开发光激活RNA碱基编辑器,用于体内基因治疗
来源:生物世界 2025-04-04 10:46
该研究开发了一种光激活 RNA 腺苷碱基编辑器——PA-rABE,该系统由 mini dCas13X 和光控 Magnets 系统驱动的分段 ADAR2dd 蛋白组成。
在基因和细胞治疗领域,基因替代疗法已广泛应用于临床。然而,如何在疾病治疗过程中实现外源基因时空特异性地反复可逆的表达调控仍面临挑战。相较于 DNA 编辑技术造成基因序列的永久改变,RNA 编辑则可通过动态可逆的方式调控蛋白质表达,这一独特优势使其成为极具潜力的基因治疗策略。目前,基于 RNA 水平的可调控基因表达系统主要包括以下几类:适配体依赖的核酸开关、小分子诱导的可变剪接系统以及 RNA 结合蛋白响应开关等。这些系统通过调控 mRNA 的稳定性、剪接过程或翻译效率来实现基因表达的可控调节。然而,现有技术主要局限于外源基因的调控,在内源基因的精确控制方面仍存在局限性。
RNA 碱基编辑系统能够在内源和外源 RNA 中执行精准的碱基转换从而实现特定基因功能的激活或者失活。腺苷 RNA 碱基编辑器因其编辑效率高,在疾病治疗中极具潜力。它以腺苷脱氨酶(ADAR)为核心催化酶,将双链 RNA 底物中的腺苷(A)转换为肌苷(I),由于肌苷与鸟苷(G)的结构相似,在蛋白质翻译过程中它能够与胞苷(C)配对,从而实现 A-to-G 的碱基转换效果。根据编辑器中 ADAR 的来源,RNA 腺苷碱基编辑器可分为两大类:第一类通过招募内源 ADAR 到靶点附近实现 A-to-I 编辑,例如 LEAPER 系统。第二类过表达与可靶向目标 RNA 模块融合的 ADAR 蛋白,实现位点特异性的 A-to-I 编辑,例如,REPAIR 系统。这些 RNA 碱基编辑器均能在细胞和动物体内实现高效编辑,但持续性表达的 ADAR 导致大量的脱靶编辑,造成安全隐患。
为解决这一问题,研究者开发了多种可调控的 RNA 编辑器。这些技术均采用持续表达完整的 ADAR 蛋白的模式,在非诱导条件下具有很高本底活性,难以实现目标 RNA 的灵敏、可控的编辑。而过表达 ADAR 蛋白会造成较严重的转录组脱靶效应以及潜在的致癌风险。因此,亟需开发出一种调控严谨、更加安全、且具有高度时空特异性的 RNA 碱基编辑工具。
2025 年 3 月 31 日,华东师范大学李大力团队、刘明耀团队和杜冰团队在 Nature Biotechnology 期刊发表了题为:Engineering a photoactivatable A-to-I RNA base editor for gene therapy in vivo 的研究论文。
该研究开发了一种光激活 RNA 腺苷碱基编辑器——PA-rABE,该系统由 mini dCas13X 和光控 Magnets 系统驱动的分段 ADAR2dd 蛋白组成。在蓝光照射下,光敏蛋白二聚化带动分段 ADAR2dd 相互靠近恢复脱氨酶活性,从而实现时空特异性的 RNA 碱基编辑。

该研究采用的光控分段脱氨酶策略赋予 PA-rABE 高度光依赖性,不仅极大地降低了 ADAR 蛋白的转录组脱靶效应,还有效地规避了过表达外源 ADAR 蛋白带来的潜在致癌风险。通过 AAV 递送,PA-rABE 成功修复了 B 型血友病小鼠的凝血功能,展示了其在精准基因治疗中的应用潜力。
为了评估 RNA 碱基编辑效率,研究团队构建了携带无义突变的 Gaussia 荧光素酶报告,简称 Gluc W160X。对 Gluc W160X 转录本上的 UAG 进行靶向编辑可以将终止密码子转换为 UIG 从而在功能上恢复 Gaussia 荧光素酶的活性,通过检测荧光素酶的强度即可判断 PA-rABE 的编辑效率。为了获得编辑效率高且没有泄露的 RNA 碱基编辑器,该团队对 PA-rABE 系统中的 Cas 蛋白、ADAR2dd 的分段位点、各基因元件的相对位置、linker 序列、DR 个数及 Magnets 突变体等进行了系统地优化。研究结果表明 PA-rABE 能灵敏地响应蓝光在细胞内实现可逆性的 RNA 编辑,不仅具有高度的空间特异性,还可以通过调节光照强度及时间灵敏地调控编辑活动的强弱。
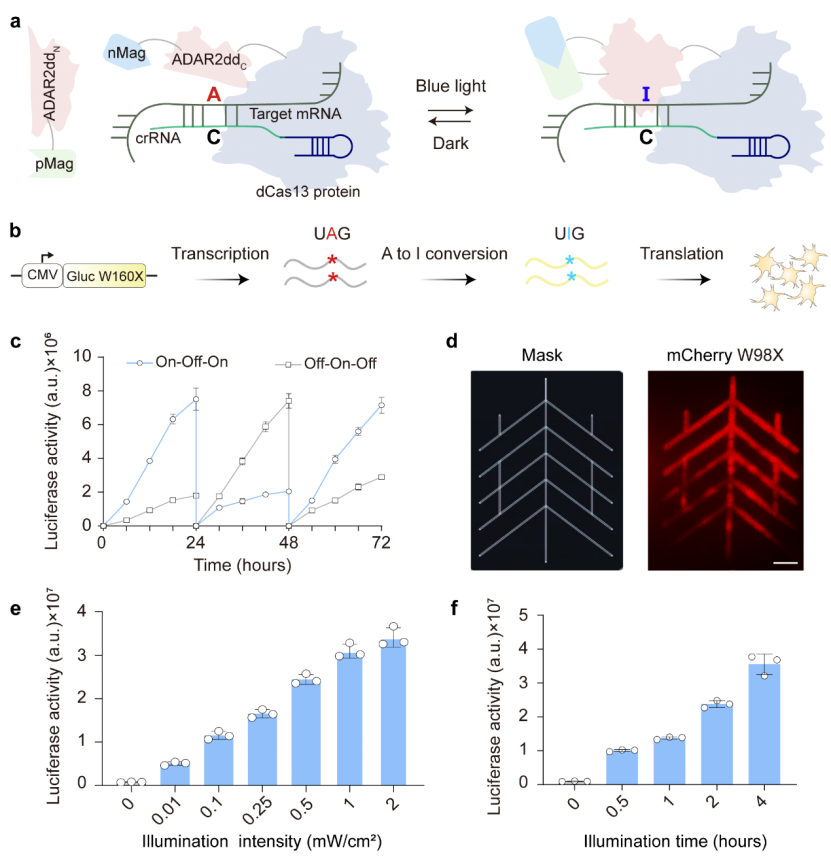
图1. PA-rABE系统的工作原理及特点表征
与非诱导的 RNA 碱基系统相比,PA-rABE 系统能高效地编辑内源 RNA,在 10 个内源转录本中的平均编辑率为 34.7%,高于 mxABE(~18.3%)和 REPAIRv2(~23.6%),且在转录组水平具有高度特异性。光照条件下,其编辑效率是近期报道的光激活 RNA 碱基编辑器 padCas13 的 2.1 倍,转录组水平的脱靶事件仅为 padCas13 编辑器的 2%。由此可见,光控分段 ADAR 策略不仅没有削弱脱氨酶活性,还通过光调控实现了对脱氨酶活性的严格监管,极大地降低了脱靶效应。此外,PA-rABE 联合特定的 crRNA 能有效地将单个或连续的双腺苷转化为肌苷,为含有提前终止密码子的遗传疾病提供了一种新的治疗方法。
为了探究 PA-rABE 在动物体内的编辑效率,该团队利用 PA-rABE 靶向外源 Fluc W426X 报告。该报告是一个失活的荧光素酶突变体,A-to-I 碱基转换可以使 Fluc W426X 的终止密码子 UAG 通读为 UIG ,从而在功能上恢复荧光素酶活性。活体成像结果表明,PA-rABE 在光照条件下修复 Fluc W426X 产生的总荧光素酶强度是其在黑暗条件下总强度的 66 倍,是 padCas13 编辑器在光照下的 17.5 倍,证明了 PA-rABE 可以在体内实现高效且严谨的外源 RNA 编辑。
为了进一步探究 PA-rABE 能否在体内编辑内源RNA,研究团队将 minicircle 编码的 PA-rABE 和 β-catenin 驱动表达的报告(TCF/LEF-Fluc)一起注射到小鼠体内。光照条件下,PA-rABE 靶向 CTNNB1,将第 41 位氨基酸由苏氨酸(T)转换成丙氨酸(A),使其编码的蛋白 β-catenin 在细胞质中免被降解,进入细胞核后激活 TCF/LEF-Fluc 表达。研究结果表明,光照组小鼠的荧光素酶信号显著增强,荧光素酶活性是黑暗组的 186 倍,证明 PA-rABE 能在体内精准地编辑功能性内源 RNA。此外,研究团队还将 PA-rABE 系统用于疾病治疗,通过 AAV 递送系统,PA-rABE 成功地在光照条件下通读 F9 基因,修复了 B 型血友病小鼠的凝血功能,展示了其在精准基因治疗中的应用潜力,为精准调控治疗性转基因表达提供了概念验证。
华东师范大学副研究员李慧莹、博士研究生邱昱皓、硕士研究生宋博闻、权心怡为论文共同第一作者;华东师范大学为第一单位;华东师范大学李大力研究员、刘明耀教授和杜冰教授为共同通讯作者。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


