Cell:发现表观遗传学新机制,向战胜癌症和衰老更进一步!
来源:生物探索 2023-04-10 11:09
DNA利用碱基ACTG排序的千变万化存储着大多数生物的遗传信息。然而,就拿人类来说,其基因组DNA拉直可以达到三米长,但是却能塞进直径不到30微米的细胞里,这显然经过了井然有序的“打包压缩”。
DNA利用碱基ACTG排序的千变万化存储着大多数生物的遗传信息。然而,就拿人类来说,其基因组DNA拉直可以达到三米长,但是却能塞进直径不到30微米的细胞里,这显然经过了井然有序的“打包压缩”。组蛋白在这一过程中就起到关键作用,由四种基本组蛋白H2A,H2B,H3和H4构成一颗“大珠子”,再让DNA缠绕在“珠子”上形成染色质的基本结构——核小体(nucleosome)。
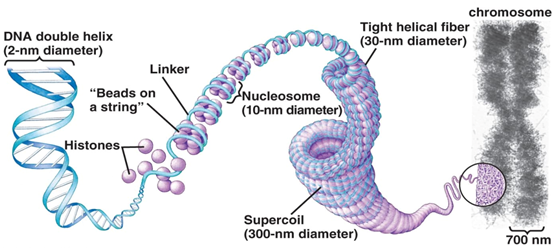
图1 DNA如何打包成染色质(图源:[1])
组蛋白构成的“大珠子”并非十分光滑,H2A,H2B,H3和H4均会延伸出一段“小尾巴”在外面。当“尾巴”上不同位置的氨基酸被修饰时,比如甲基化、乙酰化、磷酸化、泛素化等,将会对附近基因的表达起到抑制或促进的作用。这,就是表观遗传学中组蛋白修饰的部分。组蛋白修饰和其他类型的表观遗传学机制如DNA甲基化、非编码RNA的调控等一起,帮助细胞“知道自己是谁”,确保心肌细胞里不会表达神经元里才表达的基因,神经细胞不会表达肝脏细胞特有的基因等等。
组蛋白修饰的类型众多,因而有一套系统的命名方法,即:组蛋白结构+氨基酸名称+氨基酸位置+修饰类型。例如H3K4me3指的是H3组蛋白的第4位赖氨酸的三甲基化。
然而,在DNA复制和细胞分裂的过程中,组蛋白并不是简单地“Ctrl+C”、“Ctrl+V”就完成了复制,而是需要重新组装。因此,组蛋白上的修饰也需要众多复杂的机制来进行去除、保留、添加和转移,而组蛋白修饰所携带的表观遗传记忆也随之继承给了子代细胞,或在此过程中丢失。
如果子细胞丢失了过多来自母细胞的信息,将会导致基因组结构的退化,从而使得新细胞的工作能力下降,甚至做出一些不必要的行为,比如分裂过多而成为癌细胞。因此,科学家们希望更深入地了解细胞复制信息的过程,这样才能够帮助细胞更好地自我保护,延缓衰老,甚至对抗癌症的发生。
早期的研究表明,在人类和其他物种中,在正在复制的 DNA 上,旧有的和新生的(H3-H4)2四聚体将会形成不同的核小体,随机地分配到DNA复制的前导链和滞后链上。新生的(H3-H4)2四聚体将以相邻核小体的已有修饰为参照模板,重新建立其修饰模式。
然而,H2A-H2B二聚体则被发现新旧混合存在于同一个核小体中。此外,在DNA转录的过程中,H2A-H2B二聚体经常会被排斥到核小体表面,随后被新的H2A-H2B二聚体所取代,因此较难通过批量代谢/荧光标记的方法追踪H2A-H2B二聚体在复制过程中的行为。其上的组蛋白修饰在表观遗传记忆代际传递中的命运如何也仍然未知。
近日,哥本哈根大学的研究人员在Cell上发表了题为“Recycling of modified H2A-H2B provides short-term memory of chromatin states”的一项研究。在该研究中,他们公布了一种新发现的细胞表观遗传学机制。研究团队将该机制称为H2A-H2B介导的表观遗传记忆。

图2 研究成果(图源:[3])
研究人员将这一机制比喻成一种“便利贴”系统:如果我们的基因组是一本食谱,其中的烹饪配方描述了每种细胞类型所使用的正确信息组合,那么书签的存在则确保每个细胞使用了正确的配方。但当细胞分裂时,如果不能正确快速地引入书签,细胞将丢失身份并导致衰老和癌症。这就需要“便利贴”作为一种快速跟踪系统,帮助书签保持在适当的位置。
该研究的第一作者、博士后Valentin Flury 解释说:“对于表观遗传学和染色体复制领域来说,认识到我们拥有多层次的记忆信号非常重要,这些记忆信号共同允许细胞在细胞分裂过程中保持其功能。这表明在我们身体的每个细胞中指导发育和对抗癌症衰老的调控网络复杂又迷人。”
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


