《自然·医学》:**且**!北京大学肿瘤医院团队公布新靶点CAR-T治疗胃癌的临床成果
来源:奇点糕 2022-05-13 10:48
目前,CAR-T细胞疗法在肿瘤免疫治疗领域占有一席之地,是一种十分具有前景的疗法。通过对T细胞进行体外改造、嵌合特定抗原受体,可以赋予T细胞独特的“追踪功能”
目前,CAR-T细胞疗法在肿瘤免疫治疗领域占有一席之地,是一种十分具有前景的疗法。通过对T细胞进行体外改造、嵌合特定抗原受体,可以赋予T细胞独特的“追踪功能”,在患者体内特异性地识别肿瘤抗原并杀灭肿瘤细胞。
临床上,CAR-T在难治性急性B淋巴细胞白血病等多种血液恶性肿瘤中都显示出显著疗效。不过,当面对实体瘤时,CAR-T的表现却不尽如人意[1,2,3]。
有研究表明,抗原Claudin18.2(CLDN18.2)在多种实体瘤中高度表达,尤其是消化系统肿瘤,这使得CLDN18.2成为潜在的治疗靶点[4]。令人欣喜的是,在一项临床早期研究中(NCT03159819),首个针对CLDN18.2的CAR-T细胞产品——CT041,在胃癌及胃食管交界处腺癌(GC/GEJ)的治疗中已经展现出强大的潜力[5]。
这也许,会是CAR-T细胞突破实体瘤治疗瓶颈的绝佳机会。
2019年起,北京大学肿瘤医院的沈琳教授团队,正式启动CT041治疗CLDN18.2表达阳性的晚期消化系统癌症的I期临床研究(NCT03874897)。
就在前日,这项临床研究数据公布于Nature Medicine[6]。
根据结果显示,CT041疗效可观且安全可控。在输注后的28天内未发生剂量限制性毒性、3级及以上细胞因子释放综合征或神经毒性综合征,无治疗相关死亡事件。消化系统肿瘤患者的客观缓解率(ORR)和疾病控制率(DCR)分别达到48.6%、73.0%,胃癌患者的ORR/DCR分别为57.1%/75.0%。
值得一提的是,这不仅是首个针对Claudin18.2靶点的CAR-T候选产品的首秀,同时也是迄今为止最大样本的实体瘤CAR-T临床研究。

论文首页截图
在这项I期临床试验中,共有37名CLDN18.2阳性的晚期消化系统肿瘤患者纳入分析,中位年龄为53.0岁(25-74),男性占64.9%(n=24)。其中,包括28名GC/GEJ患者、5例胰腺癌(PC)患者以及4例其它类型消化系统肿瘤患者,且均发生远处转移,有50%患者的转移累及至少3个器官。全部是常规治疗失败的患者。
这些患者在第一次接受CT041输注后,完成了长达12周及以上的安全性、有效性、药代动力学评估。
接下来我们一起分享,沈琳教授团队在此次临床研究中分析所得的数据。
首先,从安全性和耐药性上看,CT041治疗的副作用整体可控。
细胞因子释放综合征(CRS)和免疫效应细胞相关神经毒性综合征(ICANS),是CAR-T疗法中频繁发生、症状突出的不良事件。而在这些接受CT041治疗的患者中,没有人发生3级及以上的CRS或ICANS,也没有发生治疗相关死亡、剂量限制性毒性(DLT)。
具体而言,有94.6%人发生1级或2级CRS,且没有观察到CRS的发生频率或严重程度与癌症类型有明显关系(由于样本量有限,尚不能完全排除潜在关联)。另外,分析表明,铁蛋白的峰值可能是CRS分级的临床指标。
除此之外,所有患者在第一次输注后28天内都发生3级及以上的血液毒性,包括白细胞减少(83.8%)、中性粒细胞减少(67.6%)、贫血(40.5%)、血小板减少(16.2%)。恢复较快,中位恢复时间为4-9天。
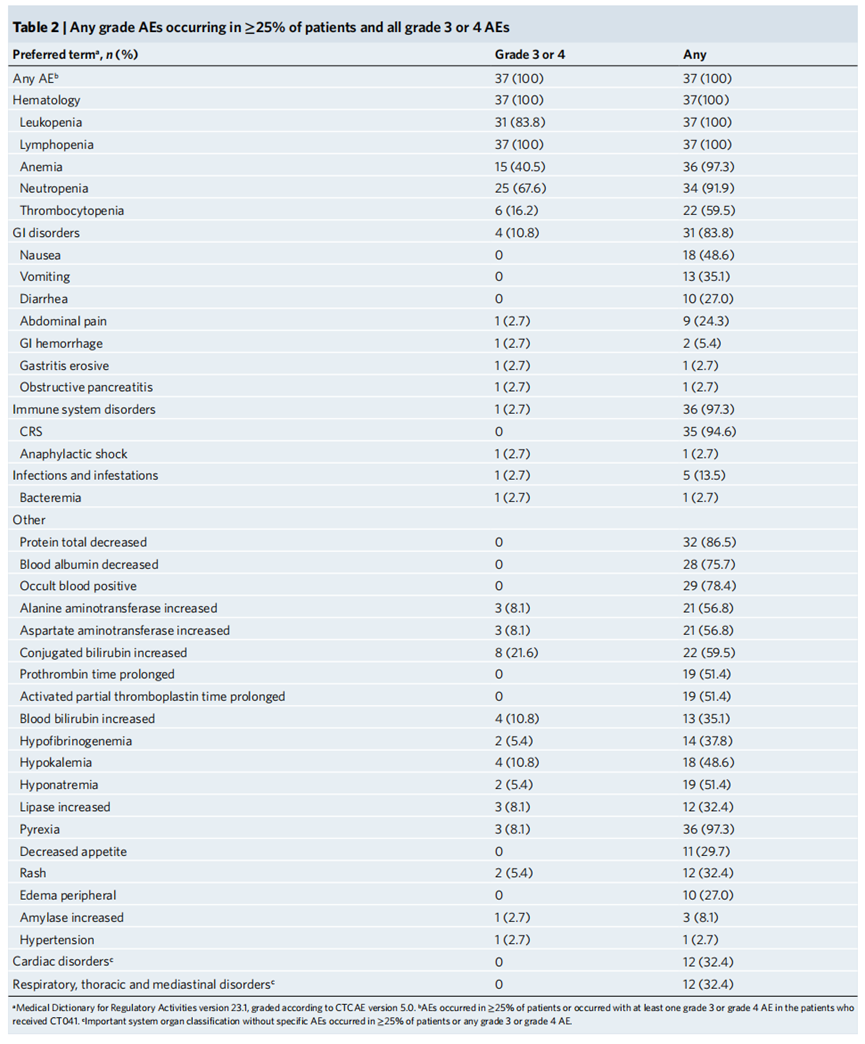
常见治疗不良事件
从疗效上来看, 83.3%的患者在接受CT041治疗后肿瘤明显消退,总体ORR和DCR分别达到48.6%和73.0%,所有患者的中位无进展生存期(PFS)为 3.7 个月,6 个月时的总生存(OS)率为 80.1%。
对于GC患者来说,ORR和DCR分别为57.1%和75.0%,中位PFS为4.2个月,6个月OS率为81.2%。
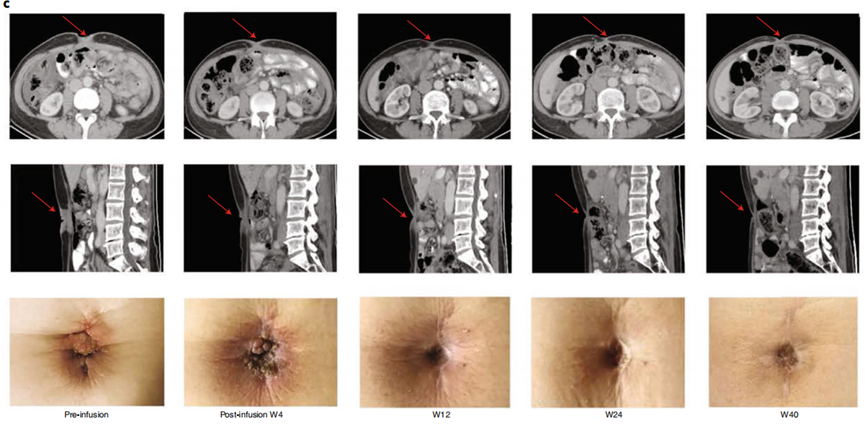
一位曾接受过PD-1抑制剂等三种治疗方案的胃癌患者(Pt08),CT041输注后脐部病变缩小
总体来说,由沈琳教授带领团队完成的这项I期临床研究结果表明,全球首个针对CLDN18.2的CAR-T细胞产品CT041,在治疗CLDN18.2表达阳性的晚期消化系统癌症患者时安全性良好,没有发生3级及以上的细胞因子释放综合征或是免疫效应细胞相关神经毒性综合征。
对于CT041在此次研究中显示出的疗效,沈琳教授团队表示,与CAR-T在血液系统肿瘤中的表现相比,目前CT041治疗实体瘤还是差点意思(ORR:70-80% vs 50-60%)。但是,相比于目前治疗胃癌的三线药物,如帕博利珠单抗、纳武利尤单抗、阿帕替尼等(ORR:13.3%[7];11.2%[8];1.7%[9]),CT041对于常规治疗失败的消化系统癌症患者来说无疑是一个充满希望的新选择。
当然,这项I期临床研究一方面是CAR -T新药的“个人秀”,表明CT041有可能成为晚期胃癌患者的重要治疗方式。另一方面,也证实CAR-T细胞疗法同样可以使实体瘤患者受益。
参考文献:
[1]Newick, K., O’Brien, S., Moon, E. & Albelda, S. M. CAR T cell therapy for solid tumors. Annu. Rev. Med. 68, 139–152 (2017).
[2]Maude, S. L. et al. Tisagenlecleucel in children and young adults with B-cell lymphoblastic leukemia. N. Engl. J. Med. 378, 439–448 (2018).
[3]Hong, M., Clubb, J. D. & Chen, Y. Y. Engineering CAR-T cells for next-generation cancer therapy. Cancer Cell 38, 473–488 (2020).
[4]Marofi, F. et al. CAR T cells in solid tumors: challenges and opportunities. Stem Cell Res. Ther. 12, 81 (2021).
[5]Tureci, O. et al. A multicentre, phase IIa study of zolbetuximab as a single agent in patients with recurrent or refractory advanced adenocarcinoma of the stomach or lower oesophagus: the MONO study. Ann. Oncol. 30, 1487–1495 (2019).
[6]https://www.nature.com/articles/s41591-022-01800-8#Tab2
[7]Fuchs, C. S. et al. Safety and efficacy of pembrolizumab monotherapy in patients with previously treated advanced gastric and gastroesophageal junction cancer. JAMA Oncol. 4, e180013 (2018).
[8]Kang, Y.-K. et al. Nivolumab in patients with advanced gastric or gastro-oesophageal junction cancer refractory to, or intolerant of, at least two previous chemotherapy regimens (ONO-4538-12, ATTRACTION-2): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet 390, 2461–2471 (2017).
[9]Li, J. et al. Randomized, double-blind, placebo-controlled phase III trial of apatinib in patients with chemotherapy-refractory advanced or metastatic adenocarcinoma of the stomach or gastroesophageal junction. J. Clin. Oncol. 34, 1448–1454 (2016).
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


