「助纣为虐的高手——乳酸」Cell最新研究表明:乳酸可促进癌细胞的侵袭、转移、血管生成以及免疫逃逸
来源:生物谷原创 2024-05-05 10:45
乳酸在肿瘤的多过程中扮演着多重角色,既是能量供应商,又是信号传导的使者,还是调控基因的高手。
你知道吗?看似平平无奇的乳酸,却是癌症的帮凶!
乳酸不仅是肿瘤细胞代谢过程中的产物,还通过多种机制促进肿瘤的生长和扩散。乳酸能够作为能量底物支持肿瘤细胞的生存,激活关键信号通路,促进肿瘤细胞的侵袭、转移、血管生成以及免疫逃逸。
最近苏州大学的周芳芳教授团队揭示了乳酸促进肿瘤细胞生长的机理。他们发现丙氨酰tRNA合成酶(AARS1)作为乳酸的传感元件,在肿瘤细胞中促进全局性的赖氨酸乳酰化过程。具体而言,有个叫丙氨酰tRNA合成酶(AARS1)的小家伙,竟然在肿瘤细胞里兼职当起了乳酸的“雷达”——AARS1通过与乳酸结合,催化生成乳酸-AMP复合物,促进p53蛋白的乳酸化,导致其活性异常,阻碍了细胞周期的调节并刺激肿瘤生长。
这一成果以“Alanyl-tRNA synthetase, AARS1, is a lactate sensor and lactyltransferase that lactylates p53 and contributes to tumorigenesis”为题被发表在《细胞》上。
癌症的一大特征是代谢失衡,可以简单理解为癌细胞的“节能模式”,即多数癌细胞在氧气充足的情况下,仍偏好进行有氧糖酵解(Warburg效应,表现为“吃糖”不完全),故意产生大量乳酸,这不仅改变了周围的居住环境,还为自己准备了一堆“能量零食”——乳酸。
乳酸不仅影响免疫细胞分化、肿瘤免疫监测、纤维化及缺血性伤害等生物学过程,还能通过蛋白乳酸化这一表观遗传修饰方式调控基因表达,尽管如此,乳酸在细胞内被识别并转化为蛋白乳酸化的具体机制仍有待阐明。
在该研究中,研究团队用蛋白质组学方法发现了众多AARS1作用靶点,特别是p53的DNA结合域中两个关键位点——赖氨酸120和赖氨酸139,它们可被乳酸化。
通过使用模拟内在乳酸化状态的p53变体进行实验,科研人员观察到,p53上的AARS1介导乳酸化会抑制其液-液相分离能力、DNA结合功能及转录激活作用。在野生型p53存在的癌症病患中,AARS1的高表达与p53的乳酸化水平与不良预后相关联。动物模型实验进一步揭示,补充β-丙氨酸能有效阻止乳酸与AARS1的相互作用,减少p53的乳酸化程度,从而减轻肿瘤的发展,这一发现彰显了AARS1通过连接肿瘤细胞的新陈代谢与蛋白质组变化,在肿瘤发生机制中的关键角色。
作为多功能的肿瘤抑制因子,p53可以激活多条防御途径,维护细胞免于癌变,这些途径涉及DNA修复、细胞周期控制及应对压力的生存机制。不幸的是,p53在肿瘤进展中频繁遭受抑制,半数以上的癌症携带有损其抑癌功能的突变。此外,p53的活性还受磷酸化、乙酰化、泛素化等多种翻译后修饰的精细调控。因此深化对p53调控机制的理解,有望为癌症治疗开辟新径,恢复或增强p53的抗癌功能。
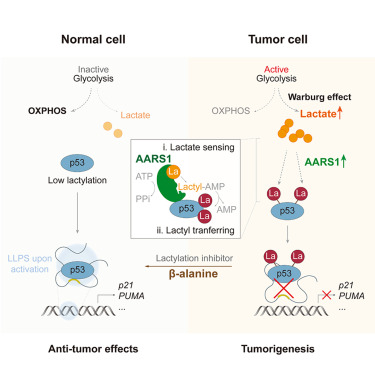
AARS1作为乳酸传感器和乳酰基转移酶,图片来源于[1]
该研究借助CRISPR筛选技术,揭示了AARS1作为细胞内乳酸感知器的功能,它直接结合乳酸并催化蛋白质的全局赖氨酸乳酸化,p53蛋白也在其作用范围内。AARS1利用ATP辅助生成乳酸-AMP中间体,将乳酸共价连接至赖氨酸残基,介导了蛋白组水平的赖氨酸乳酸化。
此外,大肠杆菌的AlaRS(EcAlaRS)也被证实能跨物种催化真核蛋白及p53的乳酸化,可见AARS1的乳酸转移酶活性具有深远的进化历史和高度保守性。AARS1能够诱导p53的DNA结合域发生特定位点乳酸化,阻碍其与p53响应元件DNA的结合,进而干扰p53的液相分离与转录活性。研究还提出利用β-丙氨酸竞争性结合AARS1以抑制p53乳酸化,为增强化疗效果提供了新策略。
这些研究成果不仅丰富了蛋白质乳酸化的基本理论,还直接阐明了代谢产物乳酸与肿瘤发生发展的紧密联系。科研人员此前就发现乳酸对肿瘤生长有促进作用,比如在2023年底,同济大学医学院/附属东方医院袁健教授的团队同样是在《细胞》上发表了题为“Metabolic Regulation of Homologous Recombination Repair by MRE11 Lactylation”的论文,他们发现乳酸能够帮助肿瘤细胞躲避化疗药物的杀伤,从而导致化疗耐药性。
具体来说,乳酸能通过使DNA修复关键蛋白MRE11乳酸化,进而促进同源重组修复(HR),导致化疗耐药,犹如给肿瘤细胞穿上一件”‘金钟罩铁布衫“。乳酸脱氢酶A低表达与HR下调相关,说明乳酸参与了HR调控。提高细胞乳酸化水平可促进HR修复,使肿瘤细胞耐药。MRE11在乙酰转移酶CBP催化下发生乳酸化,K673是其主要修饰位点。高水平的MRE11 K673乳酸化促进DNA结合与修复,导致耐药。抑制这种修饰能显著提升化疗效果,表明这是一种潜在的化疗增效策略。
综上所述,乳酸在肿瘤的多过程中扮演着多重角色,既是能量供应商,又是信号传导的使者,还是调控基因的高手。科学家们正努力揭开乳酸的神秘面纱,希望找到更多像β-丙氨酸这样的“奇兵”,通过抑制乳酸的作用,或是干扰它的代谢路径,给抗肿瘤治疗带来新的希望。未来,我们或许能在与癌症的战斗中,依靠这些科学新发现,给肿瘤细胞来个“酸爽”的反击!
参考文献:
[1]. Zong Z, Xie F, Wang S, et al. Alanyl-tRNA synthetase, AARS1, is a lactate sensor and lactyltransferase that lactylates p53 and contributes to tumorigenesis. Cell. Published online April 17, 2024. doi:10.1016/j.cell.2024.04.002
[2]. Chen Y, Wu J, Zhai L, et al. Metabolic regulation of homologous recombination repair by MRE11 lactylation. Cell. 2024;187(2):294-311.e21. doi:10.1016/j.cell.2023.11.022
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


