Nature子刊:谭蔚泓/邱丽萍团队开发核酸适配体武装的单核细胞疗法,治疗阿尔茨海默病
来源:生物世界 2025-10-05 13:20
该研究开发了核酸适配体武装的单核细胞——Apt-M,能够靶向清除细胞外 Tau 蛋白,减轻了阿尔茨海默病小鼠模型的神经炎症,还能够改善其记忆和空间学习能力,且未引发毒性或行为方面的副作用。
阿尔茨海默病(AD)是最常见的痴呆症类型,其特征是记忆和认知功能逐渐衰退。临床发现表明,细胞外的 β-淀粉样蛋白(Aβ)沉积和神经元内的神经原纤维缠结的形成与阿尔茨海默病(AD)病理生理学有关,然而,靶向这些病理特征的治疗方法,却未能阻止或逆转神经退行性病变的过程。
现在,研究人员不再仅仅关注特定的以神经元为中心的特征,而是出现了一种整体观——多种紊乱事件的复杂相互作用导致了阿尔茨海默病中神经级联反应的逐渐失调。从这个角度来看,在易受损的神经网络中识别并靶向易感节点进行干预,有望为阿尔茨海默病(AD)的防治提供新机会。
2025 年 10 月 1 日,中国科学院杭州医学研究所谭蔚泓院士/邱丽萍研究员团队在 Nature 子刊 Nature Biomedical Engineering 上发表了题为:Targeted clearance of extracellular Tau using aptamer-armed monocytes alleviates neuroinflammation in mice with Alzheimer’s disease 的研究论文。
该研究开发了核酸适配体武装的单核细胞——Apt-M,能够靶向清除细胞外 Tau 蛋白,减轻了阿尔茨海默病小鼠模型的神经炎症,还能够改善其记忆和空间学习能力,且未引发毒性或行为方面的副作用。

单核细胞(Monocytes)是一种具有机械活动性的免疫细胞,能够从血液中迁移至包括大脑在内的发炎组织。在阿尔茨海默病(AD)的背景下,循环系统中的单核细胞,尤其是 Ly6C+ 炎症亚群,能够主动穿过血脑屏障(BBB)并在大脑内积聚。一旦进入大脑,单核细胞会分化为巨噬细胞,其对细胞外神经毒性物质(例如 Aβ 沉积)具有内在的吞噬能力,从而在减缓神经退行性病变进展方面发挥积极作用。而另一方面,这些细胞有可能在特定的微环境中加剧神经炎症级联反应,从而加重阿尔茨海默病的病理状况。因此,增强单核细胞的有益功能,对于阿尔茨海默病(AD)的治疗来说是非常理想的。
细胞外的 Tau 蛋白,决定了阿尔茨海默病的发展进程,然而靶向 Tau 蛋白的治疗策略却因为难以进入大脑以及清除效率有限而受阻。
在这项最新研究中,研究团队开发了一种基于单核细胞的清除 Tau 蛋白的细胞疗法——Apt-M,该单核细胞通过高亲和力的 Tau 蛋白特异性核酸适配体进行了功能化修饰。
核酸适配体(Aptamer)由 2009 年诺贝尔生理学或医学奖获得者 Jack Szostak 命名,这是一类短的单链 DNA 或 RNA 寡核苷酸,通过形成三维空间结构,结合特定蛋白或者细胞发挥作用,其具有广泛优点,包括合成简便、可定制、热稳定性好、分子小、组织穿透能力强等。
研究团队通过生物正交化学,将核酸适配体(Aptamer)被共价偶联到单核细胞(Monocytes,来自骨髓白细胞,并在单核细胞诱导条件下培养)的表面,从而构建了 Apt-M,这未对单核细胞的活力或功能产生影响。
在表达可突变型和疾病相关 Tau 蛋白的阿尔茨海默病小鼠模型中,体内静脉给药 Apt-M,这些经过改造的 Apt-M 能够主动穿过血脑屏障,并在富含 Tau 蛋白的大脑区域(例如海马体和纹状体)聚集,进而有效地吞噬了细胞外的 Tau 蛋白,显著降低了 Tau 蛋白负担。
结果显示,Apt-M 治疗后,阿尔茨海默病小鼠模型的神经胶质细胞的激活受到抑制,神经炎症得到缓解,神经元和线粒体的完整性得以保持。长期治疗则改善了阿尔茨海默病小鼠模型的记忆和空间学习能力,且未引发毒性或行为方面的副作用。
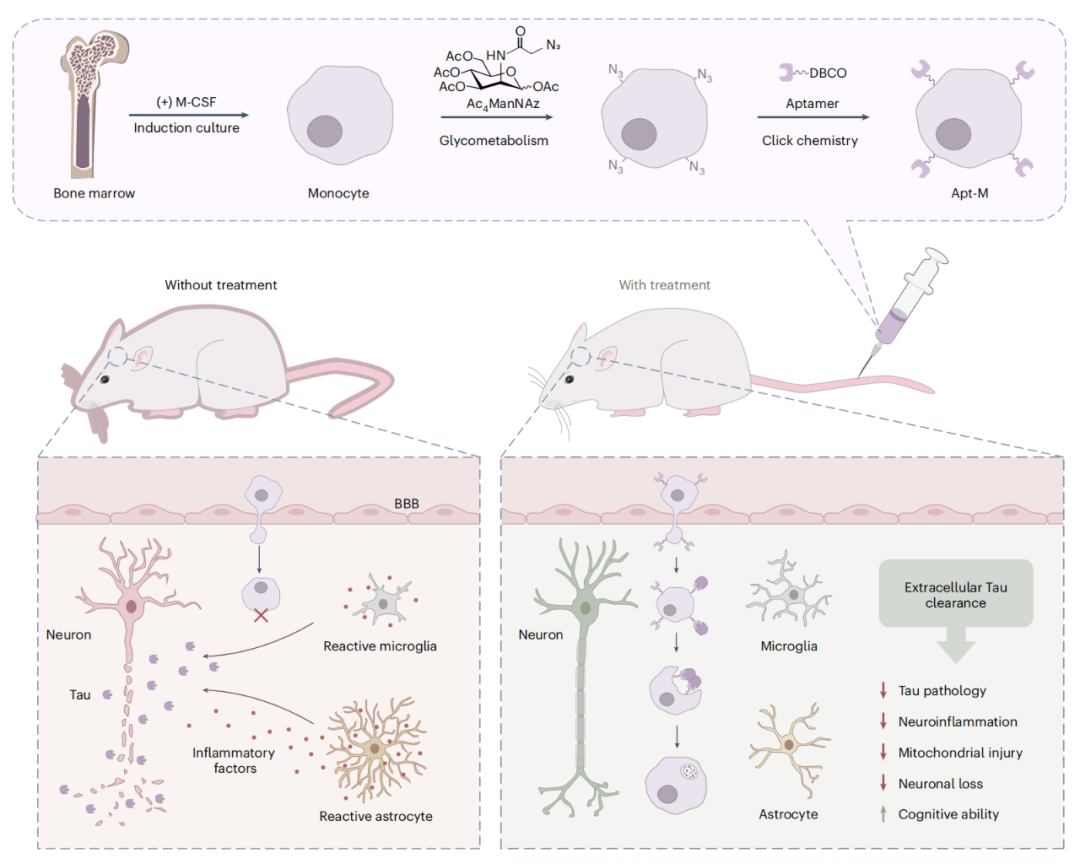
总的来说,这项研究表明,核酸适配体引导的单核细胞能够实现靶向递送、有效清除以及持续的神经保护,为阿尔茨海默病(AD)的治疗干预提供了一种很有前景的策略。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


