《自然评论·癌症》权威综述:基于mRNA的抗癌疗法,或将改变癌症治疗的未来!
来源:奇点糕 2023-07-17 17:22
“时势造英雄”,用来形容近几年的mRNA技术真是非常合适。基于mRNA技术研发的个体化癌症疫苗,此前就让学界翘首以待,而技术手段的进步,更是让围绕mRNA的更多疗法成为可能。
“时势造英雄”,用来形容近几年的mRNA技术真是非常合适。基于mRNA技术研发的个体化癌症疫苗,此前就让学界翘首以待,而技术手段的进步,更是让围绕mRNA的更多疗法成为可能。
近期,哈佛大学和浙江大学医学院的专家们就在《自然评论·癌症》(Nature Reviews Cancer)共同撰文,深度解读了当前基于mRNA的抗癌疗法发展现状,技术特点与未来发展前景,这又是一篇不容错过的好文章[1]!浙江大学医学院孔娜研究员是本文的通讯作者之一。

论文首页截图
前言
制约mRNA用于临床治疗的挑战,主要是mRNA本身不稳定且存在免疫原性,但纳米技术的进展,特别是脂质纳米颗粒的出现,才真正使基于mRNA的抗癌疗法成为可能。总体而言,基于mRNA的抗癌疗法有一个共同原理,即:mRNA被成功翻译为蛋白质,以抑制肿瘤生长或诱导/加强抗肿瘤免疫应答。
例如以mRNA直接编码抑癌蛋白,或在癌细胞内部/肿瘤微环境中编码可激活免疫应答的肿瘤新抗原、细胞因子,又或是干扰调控癌细胞存活的关键基因表达,乃至以mRNA技术进一步强化CAR-T疗法/TCR-T疗法等等,都是有可行性的思路。
此外,科研和产业界还在探索新型mRNA,如自扩增mRNA(saRNA)、反式扩增mRNA(taRNA)、环状mRNA(circRNA)的设计和应用,以及mRNA纳米微粒长期保存手段、给药途径和器官选择性的精准翻译等课题,这些探索将有望使基于mRNA的抗癌疗法更进一步,真正覆盖各种类型癌症、造福广大患者群体。
mRNA的种类和递送平台
体外人工合成的经典mRNA与真核细胞内的mRNA结构相似,且易于调整、合成简便、可大量制备,而不需进入细胞核也能规避影响遗传物质的风险,但在设计上降低免疫原性和不稳定性、提升蛋白质表达效率则尤为重要。
例如从结构优化的角度而言,可借助自体或合成类似物,对mRNA的5’端帽子结构进行优化,提高mRNA的稳定性、转录效率和激活免疫应答的能力,其它优化还有对5’端或3’端非翻译区(ORT)的化学或序列优化,对开放阅读框架(ORF)区的密码子优化,将3’端Poly(A)尾的长度控制在120-150个核苷酸等等等等。
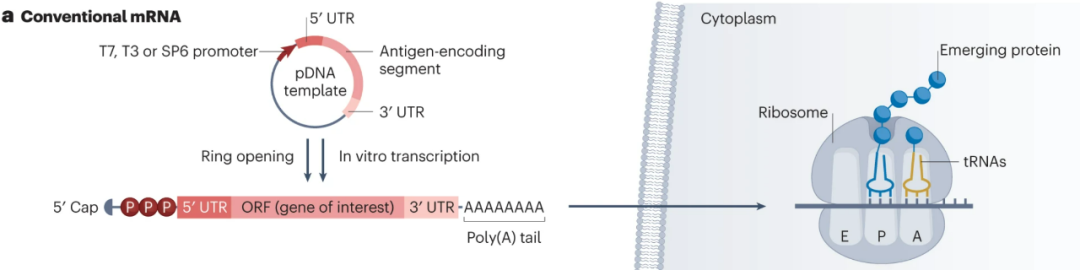
人工合成常规mRNA结构及优化的可行性
不过经典形态的mRNA也有一些问题难以克服,如在翻译开始后容易降解,因此或需多次给药以维持理想的蛋白质表达水平,可能引发副作用乃至“脱靶效应”,探索saRNA等新型mRNA就是为解决这些问题,新型mRNA往往有更稳定的结构和更高的蛋白质表达效率,乃至独特的调节作用和制备使用优势。
例如saRNA除可表达目标蛋白外,其ORF区域的非结构基因nsP1-4还可携带表达RNA依赖性RNA聚合酶(RdRP)的序列,作为亚基因组启动子,使RdRP以saRNA为模板产生更多拷贝,这让saRNA的蛋白表达持续时间比经典mRNA更长;而taRNA则有制备简便和安全的优势,circRNA的独特结构则是一把“双刃剑”。
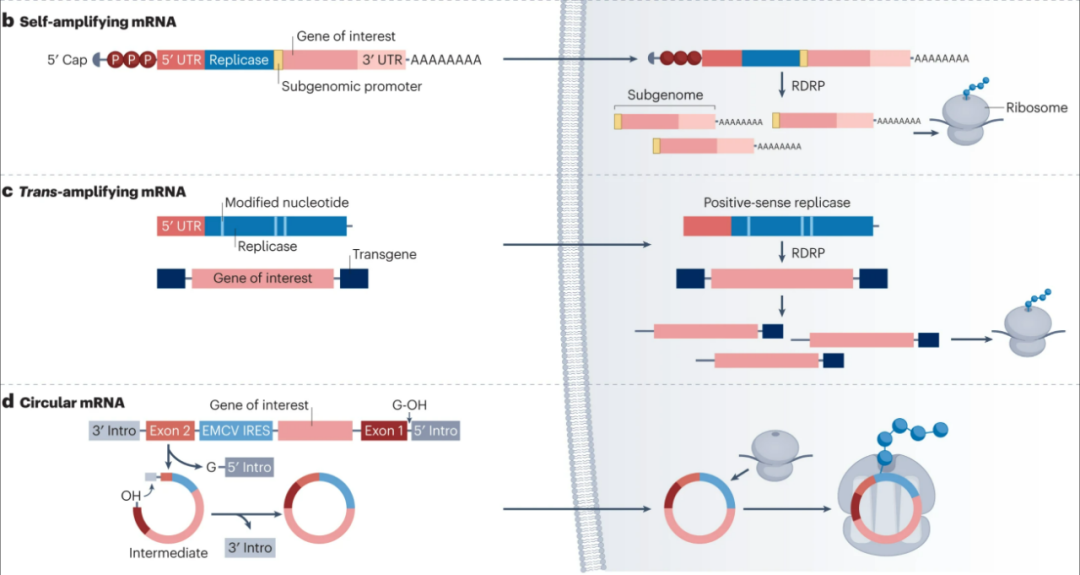
探索中的新型mRNA结构
病毒以外的mRNA载体
病毒载体是当前避免mRNA在体液内被快速降解的主要手段,但人体对相应病毒的既往免疫和新诱导免疫,也可能导致mRNA疗法效率低下,因此非病毒性的mRNA封装材料或是更优解,例如mRNA疫苗广泛使用的各种脂质载体,以及阳离子聚合物(polycations)等等,一些载体还可通过“佐剂效应”增强免疫应答。
编码肿瘤抗原的mRNA
基于癌症特点编码特异性抗原,并顺利被免疫细胞识别以激活免疫应答,是mRNA癌症疫苗的核心作用机制,而mRNA疫苗可编码的抗原也有分类,即肿瘤相关抗原(TAAs)和肿瘤特异性抗原(TSAs),需要分别进行叙述和讨论。
TAAs-mRNA疫苗
TAAs在癌症治疗中的应用相对更广泛,其特点是在癌细胞表面高表达,但也在正常组织中表达,肿瘤特异性和免疫原性较弱,且机体普遍对单一TAA高度耐受,因此癌症疫苗大多采用“TAAs组合”以增强疗效。
目前已进入临床研究阶段的树突状细胞mRNA疫苗,大多就同时编码了多个TAAs,还有在研疫苗尝试编码从肿瘤组织和肿瘤干细胞中提取的肿瘤全RNA组,以略过TAAs选择并激活强有力的免疫应答,联合化疗、免疫治疗等手段还有望进一步提升疗效,已有大量临床早期研究在探索联合治疗的可行性。
不过树突状细胞mRNA疫苗的制备复杂、花费较高,因此近年来的mRNA癌症疫苗也逐渐转向使用脂质纳米微粒(LNP)等合成载体,例如知名的Lipo-MERIT疫苗平台就将mRNA与阳离子脂质络合,靶向脾脏中的树突状细胞以激活T细胞免疫应答,基于该平台的BNT111等疫苗已在挑战关键III期临床研究。
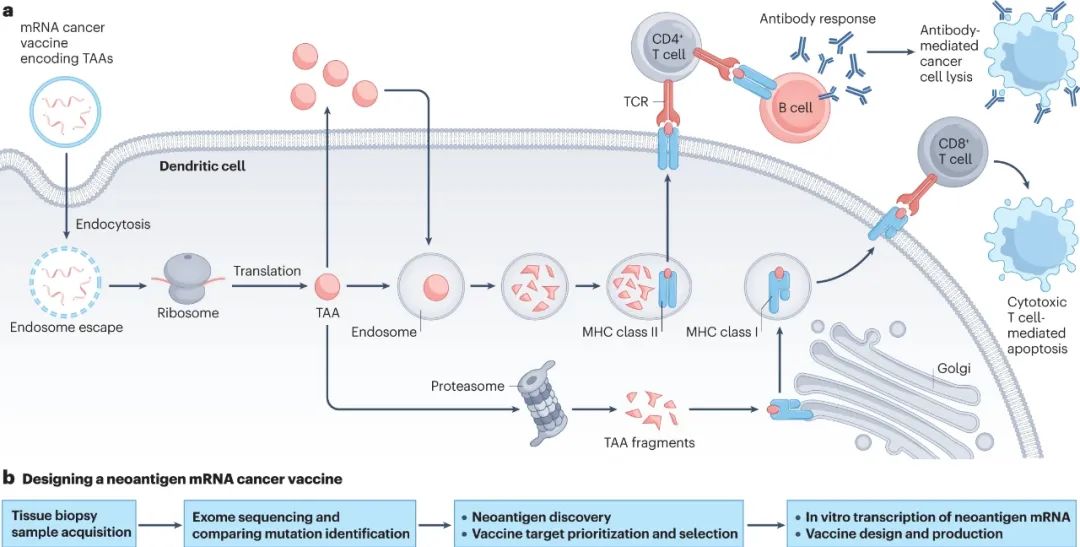
编码TAAs的mRNA癌症疫苗作用机制示意图
TSAs-mRNA疫苗
TSAs即“肿瘤新抗原”,在定义上只对应癌细胞的基因突变,因此理论上不会被免疫耐受所束缚,且不同肿瘤的突变谱差异为定制高度个体化癌症疫苗提供了可能。编码TSAs的mRNA癌症疫苗,设计上仍采用上文提到的LNP和病毒载体两条路线,可同时编码数十个TSAs,但制备较为繁琐且价格高昂。
以mRNA编码细胞因子
细胞因子对肿瘤微环境有显著的调节作用,但采用类似系统性化疗的方法注射细胞因子只会“事倍功半”,疗效、安全性和给药方式等多方面表现都不尽人意,但mRNA技术有望解决制约传统细胞因子疗法的一系列瓶颈,如半衰期较短、无法将给药范围局限于肿瘤微环境局部、制备繁琐且耗时长等等。
目前被重点探索用于mRNA疗法的细胞因子有IL-2、IL-12和干扰素-α等,瘤内注射由LNP封装的相应编码mRNA,可在动物实验中有效激活免疫应答。而与mRNA疫苗类似,同时混用多种细胞因子的mRNA,可激活更广泛的免疫应答,如IL-23/IL-36/OX40L-mRNA组合疗法就在临床前研究中表现出色[2]。
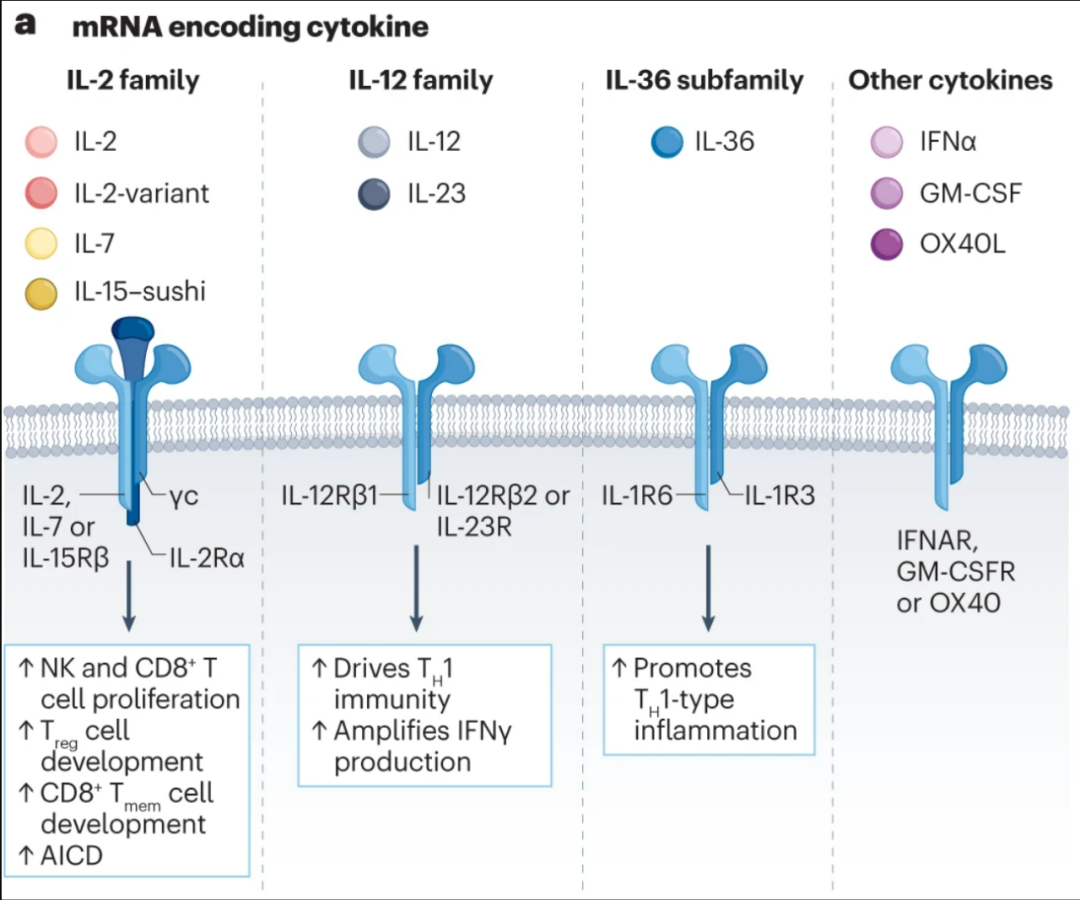
以mRNA编码关键细胞因子调节抗肿瘤免疫应答的目标
以mRNA编码抑癌蛋白
利用纳米微粒等载体递送编码p53、PTEN等关键抑癌蛋白的mRNA,有望快速、大幅提高抑癌蛋白表达水平以有效抗癌,如2019年本文作者团队开展的一项研究,即初步验证了瘤内注射TP53 mRNA纳米微粒的可行性,该疗法对肝癌和非小细胞肺癌有抗肿瘤活性,还有望增敏现有抗癌药物(依维莫司)[3]。
抑癌蛋白不仅本身有重要生理功能,还对肿瘤微环境有显著调节作用,撰写本次综述的哈佛团队已开展研究证实:编码p53的mRNA与PD-1抑制剂联合使用可协同增效[4],这将是未来值得深入探索的“免疫Combo”之一。

以mRNA编码抑癌蛋白,双管齐下抗癌
以mRNA编码Cas9用于基因编辑
CRISPR-Cas9基因编辑技术不仅是科研利器,也有望成为抗癌大杀器,但其起效的关键是小向导RNA(sgRNA)和Cas9成功被递送到靶细胞内,而mRNA技术可助力Cas9的递送,且Cas9 mRNA可显著减少脱靶效应和基因毒性。
2020年中美两国学者共同开发的选择性器官靶向脂质纳米颗粒(SORT-LNP)技术,则突破了传统病毒载体的局限性,使编码Cas9的mRNA能够被成功递送到肝脏以外的器官起效[5],基因编辑效率也较好。基于SORT-LNP平台开发的mRNA药物已在2023年完成临床I期研究首例给药,预计也将很快正式进军抗癌治疗。
此外,还有研究尝试在脂质纳米颗粒里同时封装Cas9 mRNA和sgRNA,使用于卵巢癌和胶质母细胞瘤时的基因编辑效率提升到了70-80%,后续研究则在此基础上,进一步封装了关键基因的小干扰RNA(siRNA)来继续增效[6]。
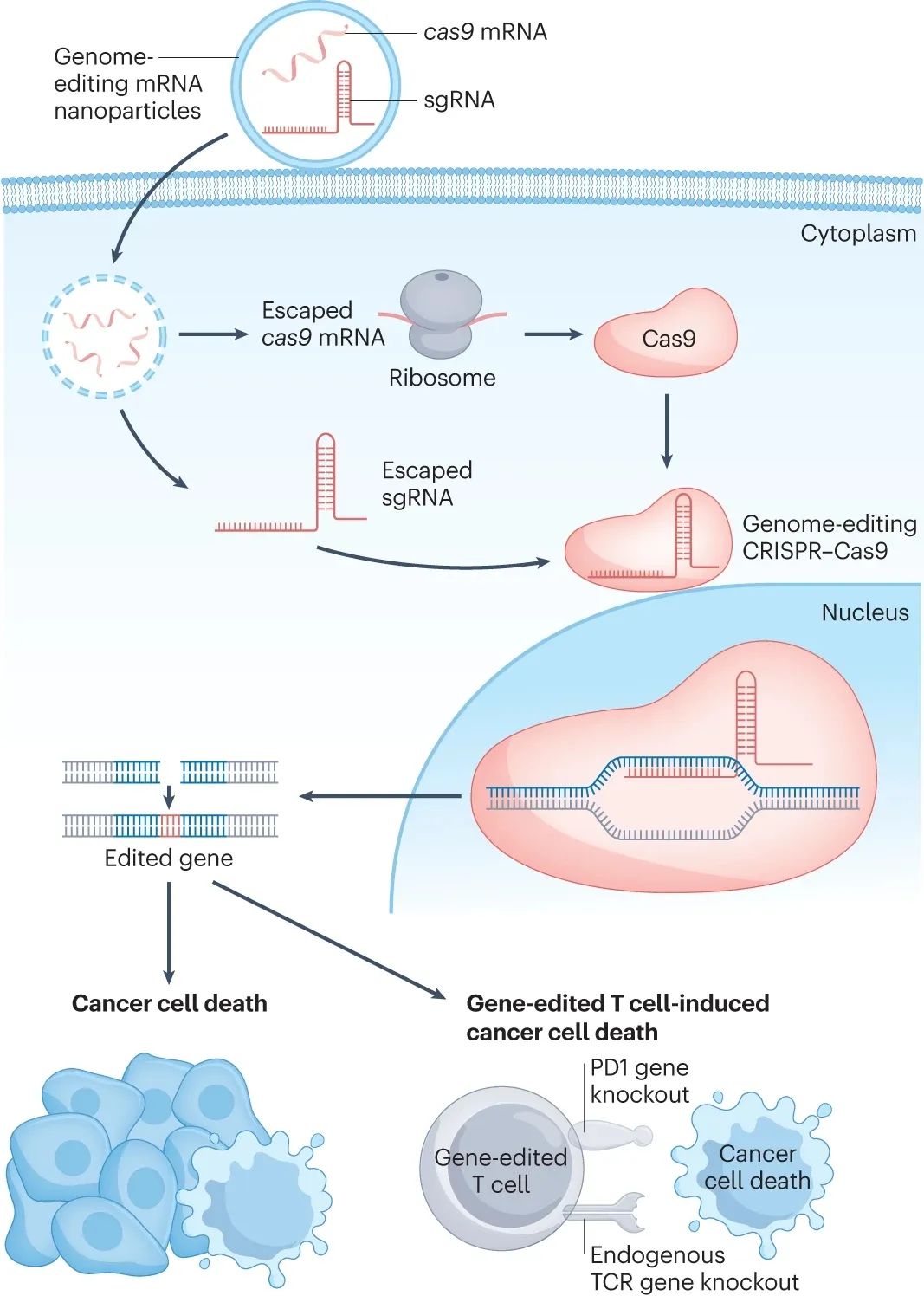
以mRNA编码Cas9介导基因编辑,助力抗癌治疗
以mRNA编码CAR或TCR
CAR-T或TCR-T细胞疗法的体外改造过程,往往需要以逆转录病毒或慢病毒载体,将CAR/TCR序列插入患者T细胞基因组,但转染存在诱发基因突变的风险,而mRNA技术可有效降低风险并提高转染率,如mRNA电穿孔技术导入CAR已成为科研探索的首选,该方法可使CAR在T细胞表面短暂表达约1周。
以mRNA诱导CAR/TCR的短时间内表达,可避免CAR/TCR存在时间过长引发的风险,还可同时递送其它免疫活性物质以实现协同增效,但缺点在于需重复多次给药,为此需继续优化mRNA结构以提升其稳定性和翻译效率。
当前已有多种借助mRNA技术的CAR-T疗法进入临床早期研究,但mRNA技术可能有着更大的意义:注射精准靶向T细胞、且编码CAR/TCR的mRNA-LNP,如能在体内对T细胞实现重编程,并产生可持续扩增的CAR-T/TCR-T细胞,就有望解决当前过继性疗法个体化制备的许多难题,但探索还只是刚刚起步而已。
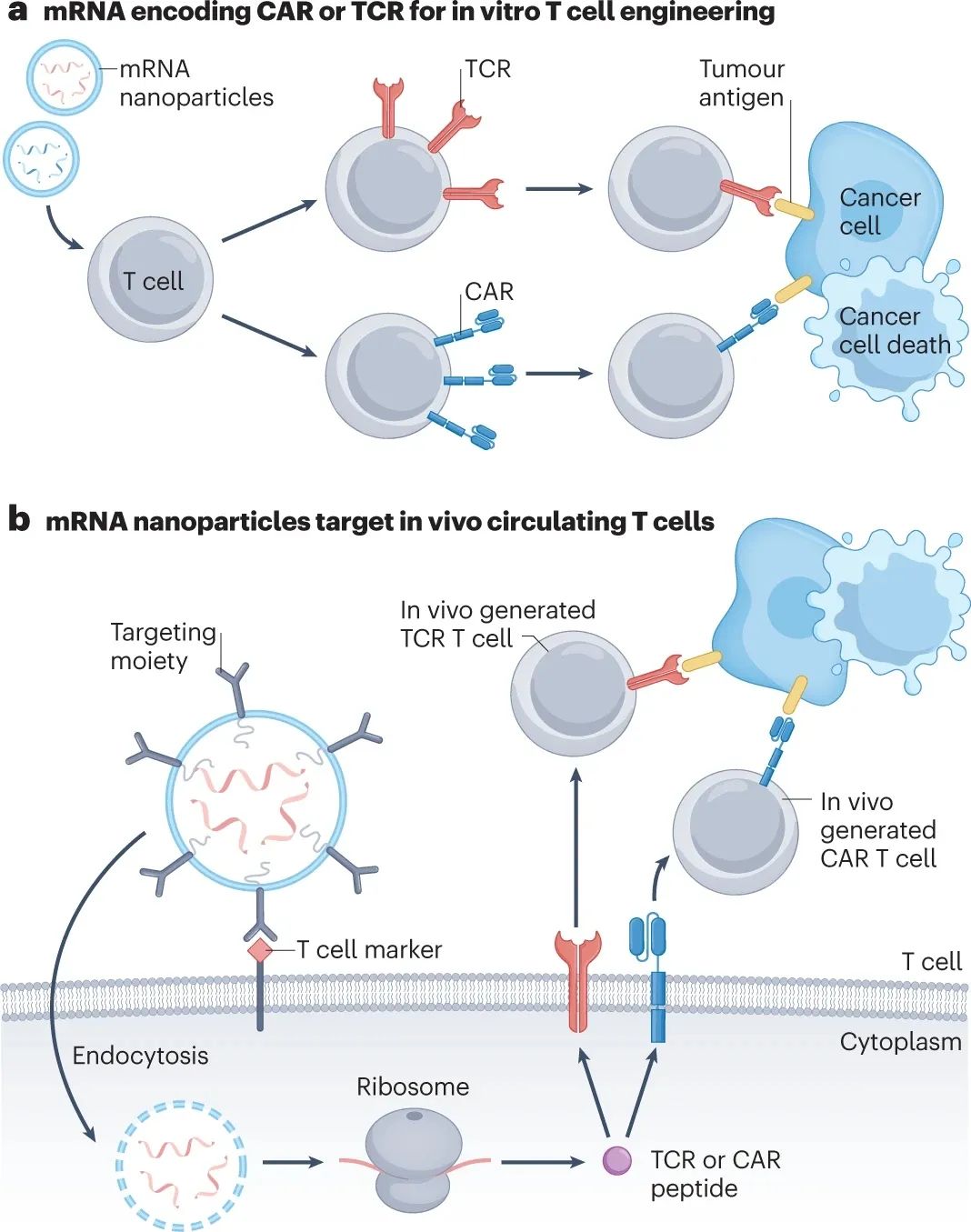
以mRNA编码CAR或TCR
结语及未来
mRNA技术必将在未来参与到各种疾病的治疗之中,而癌症很有可能就是第一个关键战场,为此mRNA技术和相关疗法的开发,需要继续破解多个难题:
1.设计mRNA疫苗时应选择更合适和有效的肿瘤抗原,为此需有效识别和筛选新抗原,制备疫苗也必须更快速和廉价,高通量基因测序和数据分析提升将是关键;
2.为突破mRNA的递送瓶颈,如仅能递送到肝脏等纳米微粒的常见靶器官,药物递送平台需要全面拓展升级,未来研究可考虑借助“遗传条形码”追踪mRNA在体内的递送流程和特点,分析突破体内关键屏障的需求,也可考虑外泌体递送或张峰团队开发的SEND系统[7]等选项;
3.mRNA疗法的给药方式可参考mRNA疫苗尝试创新,如采用口服、可溶性微针贴片或吸入式凝胶等,提升对特定部位的给药效率;
4.继续探索新型mRNA即saRNA、taRNA和circRNA等的应用,解决延长mRNA翻译产物持续存留时间的关键问题,并积极尝试与现有免疫治疗的联合;
5.由于Cas9 mRNA长度远超常规mRNA,给封装带来了很大挑战,未来可能需转向封装编码基因编辑工具蛋白,如IscB、IsrB的mRNA。
参考文献:
[1]Liu C, Shi Q, Huang X, et al. mRNA-based cancer therapeutics[J]. Nature Reviews Cancer, 2023.
[2]Hewitt S L, Bai A, Bailey D, et al. Durable anticancer immunity from intratumoral administration of IL-23, IL-36γ, and OX40L mRNAs[J]. Science Translational Medicine, 2019, 11(477): eaat9143.
[3]Kong N, Tao W, Ling X, et al. Synthetic mRNA nanoparticle-mediated restoration of p53 tumor suppressor sensitizes p53-deficient cancers to mTOR inhibition[J]. Science Translational Medicine, 2019, 11(523): eaaw1565.
[4]Xiao Y, Chen J, Zhou H, et al. Combining p53 mRNA nanotherapy with immune checkpoint blockade reprograms the immune microenvironment for effective cancer therapy[J]. Nature Communications, 2022, 13: 758.
[5]Cheng Q, Wei T, Farbiak L, et al. Selective organ targeting (SORT) nanoparticles for tissue-specific mRNA delivery and CRISPR–Cas gene editing[J]. Nature Nanotechnology, 2020, 15(4): 313-320.
[6]Zhang D, Wang G, Yu X, et al. Enhancing CRISPR/Cas gene editing through modulating cellular mechanical properties for cancer therapy[J]. Nature Nanotechnology, 2022, 17(7): 777-787.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


