研究揭示Gabija复合物抗噬菌体侵染的分子机理
来源:生物物理所 2024-02-03 12:02
中国科学院生物物理研究所研究员卫涛涛团队联合深圳湾实验室研究员马军团队等,报道了Gabija八聚体复合物的结构,阐明了Gabija系统发挥免疫防御作用的分子机制。
为了应对噬菌体的入侵,原核生物演化出多种精巧的免疫系统以实现自我保护。对原核生物免疫系统的深入研究催生了多种具有里程碑意义的分子生物学工具,包括在分子克隆实验中广泛应用的限制性核酸内切酶系统,以及在基因编辑领域中大放异彩的CRISPR-Cas系统等。然而,细菌和古菌基因组中还有一大批功能尚不明确的原核免疫系统相关基因,其中Gabija基因在已测序细菌和古菌基因组中的出现率超过15%,是原核生物中最常见的抗噬菌体防御系统之一。
Gabija系统由GajA和GajB两种蛋白组成,GajA蛋白被鉴定为序列特异性的DNA缺刻核酸内切酶,其活性受到核苷酸浓度的严格调控;GajB蛋白被预测为类似Uvrd的解旋酶。携带Gabija系统的大肠杆菌对噬菌体侵染表现出强烈的免疫效果,但Gabija系统分子机器的组装形式及其保护原核生物免受噬菌体侵染的结构基础仍有待揭示。
中国科学院生物物理研究所研究员卫涛涛团队联合深圳湾实验室研究员马军团队等,在《自然-通讯》(Nature Communications)上发表了题为Structural and biochemical insights into the mechanism of the Gabija bacterial immunity system的研究论文,报道了Gabija八聚体复合物的结构,阐明了Gabija系统发挥免疫防御作用的分子机制。Gabija复合物是由四个GajA蛋白和四个GajB蛋白组成的八聚体。GajA蛋白形成四聚体,构筑Gabija复合物核心组件;四个GajB蛋白分别以单体的形式结合在复合物外周。大肠杆菌抗噬菌体侵染实验证明,在细菌中单独表达GajA蛋白或GajB蛋白均无法抵抗噬菌体的入侵,而破坏GajA蛋白和GajB蛋白的相互作用界面明显减弱Gabija复合物的抗噬菌体功能,提示4:4组装的GajA/B复合物对抵御噬菌体至关重要。
该研究还发现,Gabija复合物具有序列特异性的DNA内切酶活性,更倾向于选择环状DNA作为底物,且其内切酶活性对核苷酸浓度的响应比单独的GajA蛋白更敏感。GajB蛋白中ATP酶结构域关键位点的突变能够解除核苷酸对于Gabija复合物DNA内切酶活性的抑制,提示GajB可作为细胞能量状态的感受器,通过响应胞内核苷酸的浓度,精确调节GajA蛋白的核酸酶活性。基于冷冻电镜结构解析及生化实验,该研究提出了Gabija免疫系统发挥抗病毒作用的模型:在正常生理状态下,细胞内的NTP和dNTP浓度较高,抑制了Gabija复合物的核酸内切酶活性,而在噬菌体入侵、病毒DNA高强度复制和转录时,细胞内的NTP和dNTP耗竭,迅速激活Gabija复合物。该复合物切割环状DNA以抑制噬菌体DNA复制,进而阻断噬菌体扩增。
该研究与近期发表的其他工作共同揭示了Gabija系统感知噬菌体入侵的分子机制及其切割DNA底物的偏好选择,为探索宿主抗噬菌体免疫及噬菌体免疫逃逸的相关研究提供了新的方向。此外,Gabija系统也有望为分子生物学工具酶的研发奠定结构和生化基础。
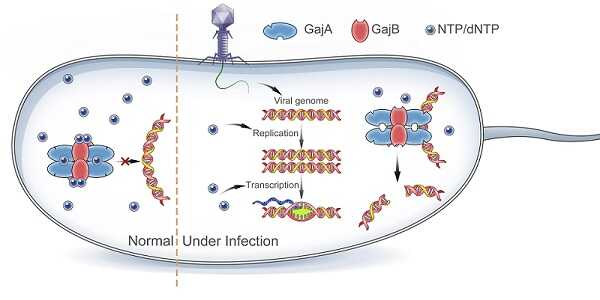
 Gabija系统抗噬菌体侵染的分子机制
Gabija系统抗噬菌体侵染的分子机制
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


