维迪西妥单抗获CDE突破性治疗认可,有望填补HER2阳性尿路上皮癌治疗空白
来源:生物谷 2020-12-29 09:25
12月28日,荣昌生物开发的抗体偶联药物(ADC)维迪西妥单抗(disitamab vedotin,RC48-ADC)被CDE正式授予突破性疗法资格。适应症为既往经过化疗失败后进展的HER2过表达局部晚期或转移性尿路上皮癌患者(包括膀胱、输尿管、肾盂及尿道来源)。针对该适应症,美国FDA在9月21日已经授予了维迪西妥单抗突破性疗法认可。
12月28日,荣昌生物开发的抗体偶联药物(ADC)维迪西妥单抗(disitamab vedotin,RC48-ADC)被CDE正式授予突破性疗法资格。适应症为既往经过化疗失败后进展的HER2过表达局部晚期或转移性尿路上皮癌患者(包括膀胱、输尿管、肾盂及尿道来源)。针对该适应症,美国FDA在9月21日已经授予了维迪西妥单抗突破性疗法认可。
长期以来,手术和含铂化疗是尿路上皮癌的重要治疗手段。对于不能手术的晚期患者,一线疗法通常是含铂药物化疗,对化疗的耐药,会导致肿瘤复发和疾病进展,预后不佳。有文献数据显示,转移性晚期尿路上皮癌患者的中位总体生存期仅14个月左右[1],亟需更有效的治疗手段。
维迪西妥单抗填补HER2阳性尿路上皮癌巨大临床需求
尿路上皮癌是世界范围内排名第九位的常见的恶性肿瘤,其发病率及死亡率均占男性泌尿生殖系统肿瘤的首位,且呈逐年上升的趋势。,大多数(90%-95%)发生在下尿路(膀胱和尿道),其余发生在上尿路(肾盏、肾盂和输尿管)[2]。膀胱癌作为尿路上皮癌最常见的类型,根据Datamonitor Healthcare估算,2018年全球有超过54万例新确诊患者,这一数字到2027年预计将增加到60万例。膀胱癌是美国和欧洲第五大最常见癌症,在中国是第六大男性致死性恶性肿瘤,2015年中国约有6.2万例新确诊病例。
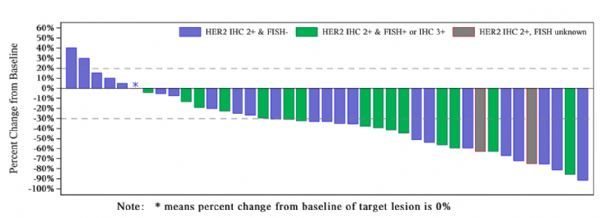
此前,维迪西妥单抗获得美国FDA在尿路上皮癌上的突破性疗法认定,是基于一项由北京大学肿瘤医院副院长郭军教授牵头的II期研究结果。数据显示,43例经一线及以上系统化疗失败的尿路上皮癌受试者接受维迪西妥单抗治疗的客观缓解率(cORR)高达51.2%,疾病控制率(DCR)高达90.7%,接受过免疫治疗的患者ORR为62.5%。截至2019年4月30日,中位PFS 6.9个月。
当前,国内外尚未有治疗HER2阳性尿路上皮癌的药品获批。维迪西妥单抗针对这一细分人群实现了疗效上的重大突破,不仅有效率高,而且大幅延长了一线治疗失败患者的生存期,可以满足巨大的临床需求。维迪西妥单抗凭借已取得的临床数据被CDE授予突破性疗法认定,在中国的临床开发和注册进程无疑也会大大加快,有望填补HER2阳性尿路上皮癌的临床治疗空白。
参考资料
[1]晚期尿路上皮癌的治疗进展,Journal of Practical Oncology(2020),Vol.35:292-297
[2]上尿路上皮癌的手术治疗进展,东南国防医药,2020,22(4):399-402
长期以来,手术和含铂化疗是尿路上皮癌的重要治疗手段。对于不能手术的晚期患者,一线疗法通常是含铂药物化疗,对化疗的耐药,会导致肿瘤复发和疾病进展,预后不佳。有文献数据显示,转移性晚期尿路上皮癌患者的中位总体生存期仅14个月左右[1],亟需更有效的治疗手段。
维迪西妥单抗填补HER2阳性尿路上皮癌巨大临床需求
尿路上皮癌是世界范围内排名第九位的常见的恶性肿瘤,其发病率及死亡率均占男性泌尿生殖系统肿瘤的首位,且呈逐年上升的趋势。,大多数(90%-95%)发生在下尿路(膀胱和尿道),其余发生在上尿路(肾盏、肾盂和输尿管)[2]。膀胱癌作为尿路上皮癌最常见的类型,根据Datamonitor Healthcare估算,2018年全球有超过54万例新确诊患者,这一数字到2027年预计将增加到60万例。膀胱癌是美国和欧洲第五大最常见癌症,在中国是第六大男性致死性恶性肿瘤,2015年中国约有6.2万例新确诊病例。
此前,维迪西妥单抗获得美国FDA在尿路上皮癌上的突破性疗法认定,是基于一项由北京大学肿瘤医院副院长郭军教授牵头的II期研究结果。数据显示,43例经一线及以上系统化疗失败的尿路上皮癌受试者接受维迪西妥单抗治疗的客观缓解率(cORR)高达51.2%,疾病控制率(DCR)高达90.7%,接受过免疫治疗的患者ORR为62.5%。截至2019年4月30日,中位PFS 6.9个月。
当前,国内外尚未有治疗HER2阳性尿路上皮癌的药品获批。维迪西妥单抗针对这一细分人群实现了疗效上的重大突破,不仅有效率高,而且大幅延长了一线治疗失败患者的生存期,可以满足巨大的临床需求。维迪西妥单抗凭借已取得的临床数据被CDE授予突破性疗法认定,在中国的临床开发和注册进程无疑也会大大加快,有望填补HER2阳性尿路上皮癌的临床治疗空白。
参考资料
[1]晚期尿路上皮癌的治疗进展,Journal of Practical Oncology(2020),Vol.35:292-297
[2]上尿路上皮癌的手术治疗进展,东南国防医药,2020,22(4):399-402
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->