国产ADC炫技ASCO 2025
来源:医药魔方 2025-06-03 09:45
5月30日-6月3日,2025年美国临床肿瘤学会(ASCO)年会将在美国芝加哥举行。ASCO年会是全球肿瘤领域最权威的学术交流盛会,每年都会展示当前国际最前沿的临床肿瘤学科研成果和治疗技术。
产品:DB-1311(BNT324)
药物靶点+类型:B7-H3 ADC
公司:映恩生物
全球研发赛道排名:5/37
该I/II期研究纳入了65例既往接受过多种治疗的去势抵抗性前列腺癌(CRPC)患者,评估了6mg/kg(每3周1次)和9mg/kg(每3周1次)两个剂量的疗效和安全性。
在43例疗效可评估的患者中,未确认的客观缓解率(ORR)为27.9%(12/43,8例已确认),疾病控制率为95.3%(41/43)。中位缓解持续时间(DOR)尚未达到。中位随访5.7个月时,中位影像学无进展生存期(rPFS)为8.3个月,6个月rPFS率为86.6%。
具体到亚组,6mg/kg和9mg/kg剂量组的ORR分别为26.3%和29.2%,DCR分别为100%和91.7%,6个月rPFS率为88.7%和80.0%;接受过至多3种治疗的患者,ORR为33.3%,DCR为77.8%;接受过至少4种治疗的患者,ORR为26.7%,DCR为100%;Lu-177经治患者,ORR为25.0%,DCR为100%;肿瘤免疫(IO)疗法经治患者,ORR为33.3%,DCR为100%;PARP抑制剂经治患者,ORR为16.7%,DCR为100%。
产品:LM-302
药物靶点+类型:CLDN18.2 ADC
公司:礼新医药
全球研发赛道排名:4/21
该研究纳入了43例经组织学证实、既往未接受过治疗、不可切除、HER2阴性胃癌或胃食管交界处腺癌或食管腺癌患者,评估了LM-302(1.6mg/kg或2.0mg/kg,每3周1次,1.8mg/kg,每2周1次)联合特瑞普利单抗(240mg,每3周1次或3mg/kg,每2周1次)的疗效和安全性。
在41例疗效可评估的患者中,中位随访6.01个月时,ORR为65.9%,DCR为85.4%,中位PFS和OS尚未达到。在CLDN18.2肿瘤表达≥25%(IHC 2+/3+)亚组中,ORR为71.9%,DCR为96.9%;在PD-L1 CPS <1和PD-L1 CPS≥1亚组中,ORR分别为63.3%和77.8%。
安全性方面,未观察到剂量限制性毒性(DLT)。治疗相关不良事件(TRAE)发生率为90.7%(39/43),3级及以上TRAE发生率为37.2%(16/43)。
产品:JSKN-016
药物靶点+类型:TROP2/HER3双抗ADC
公司:康宁杰瑞
全球研发赛道排名:1/1
截至2024年12月23日,该研究招募了6例经治转移性三阴性乳腺癌(TNBC)患者,评估了JSKN-016(4-8mg/kg,每3周1次)的疗效和安全性。
在5例疗效可评估的患者中,ORR为80.0%,DCR为100%,PFS尚未达到。安全性方面,没有患者出现间质性肺病,也没有患者因治疗期间不良事件(TEAE)停药或死亡。

产品:芦康沙妥珠单抗
药物靶点+类型:TROP2 ADC
公司:科伦博泰
全球研发赛道排名:2/57
本次ASCO大会,芦康沙妥珠单抗有4项临床研究成果入选,选取其中3项进行介绍。
OptiTROP-Lung01研究共纳入81例既往未接受过系统治疗且无驱动基因突变的晚期非鳞状非小细胞肺癌(NSCLC)患者,评估了芦康沙妥珠单抗(5mg/kg,每2周1次或每3周1次)联合塔戈利单抗(1200mg,每3周1次或900mg,每周1次)的疗效和安全性。结果显示,中位随访17.1个月时,确认的ORR(cORR)为59.3%,中位DOR为16.5个月,中位PFS为15.0个月。在PD-L1 TPS ≥50%的亚组中,cORR为77.8%,中位PFS为17.8个月;在PD-L1 TPS ≥1%的亚组中,cORR为68.1%,中位PFS为17.8个月;在PD-L1 TPS <1%的亚组中,cORR为47.1%,中位PFS为12.4个月。
II期OptiTROP-Breast05研究共纳入41例既往未接受过治疗的不可切除的局部晚期或转移性TNBC患者,评估了芦康沙妥珠单抗单药(5mg/kg,每2周1次)的疗效和安全性。结果显示,中位随访18.6个月时,ORR为70.7%,DCR为92.7%,中位DOR为12.2个月,中位PFS为13.4个月。在PD-L1 CPS<10的32例患者中,ORR为71.9%,DCR为93.8%,中位PFS为13.1个月。
III期OptiTROP-Lung03研究共纳入137例经EGFR-TKI治疗及铂类化疗后进展的晚期EGFR突变NSCLC患者。结果显示,中位随访12.2个月时,芦康沙妥珠单抗单药组BIRC评估的cORR高于多西他赛组(45.1% vs 15.6%,单侧p=0.0004);BIRC评估的中位PFS显著延长(6.9个月 vs 2.8个月,HR=0.30,单侧p<0.0001),研究者评估的中位PFS分别为7.9个月和2.8个月(HR=0.23)。由于多西他赛组中有36.4%的患者交叉接受了芦康沙妥珠单抗治疗,两组的中位OS均尚未达到(HR=0.49,单侧p=0.007)。对于因交叉给药而调整的中位OS,经预设的保秩结构失效时间(RPSFT)模型分析,多西他赛组为9.3个月,芦康沙妥珠单抗组尚未达到(HR=0.36)。
产品:9MW2821
药物靶点+类型:Nectin-4 ADC
公司:迈威生物
全球研发赛道排名:2/24
本次公布结果的是一项开放标签、多中心的Ib/II期研究,旨在评估9MW2821联合特瑞普利单抗在未接受过治疗的局部晚期/转移性尿路上皮癌(la/m UC)患者中的安全性和有效性。
截至2024年12月19日,该研究共纳入40例la/m UC患者,ORR为87.5%(35/40),cORR为80%(32/40),其中3例实现完全缓解,DCR为92.5%(37/40)。中位PFS和DOR尚未达到,6个月PFS率和3个月DOR率分别为79.1%和100%。此外,肝转移、膀胱癌以及Nectin-4表达阴性亚组ORR分别为88.2%、94.4%和100%。
产品:瑞康曲妥珠单抗(SHR-A1811)
药物靶点+类型:HER2 ADC
公司:恒瑞医药
全球研发赛道排名:6/77
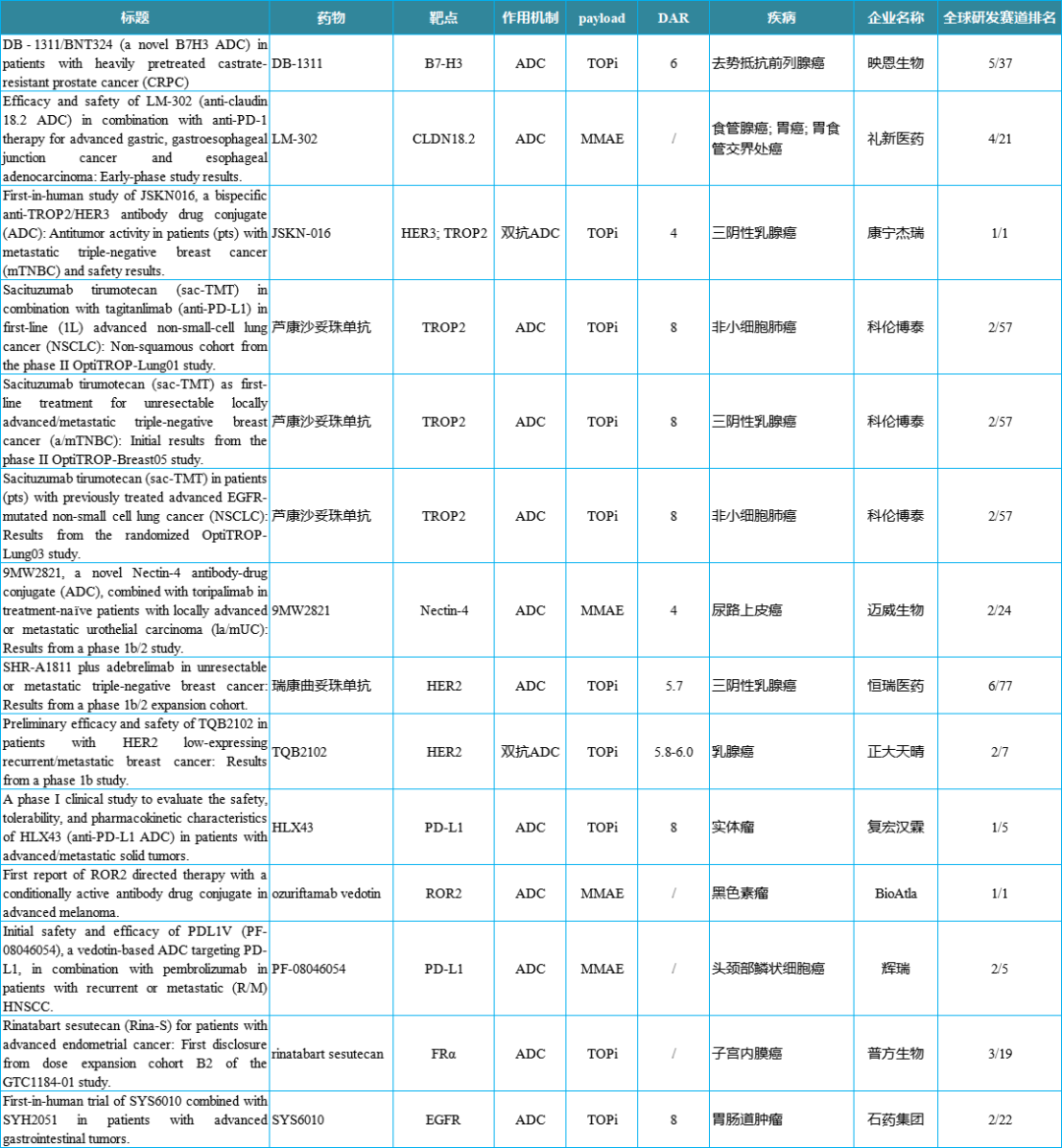
该Ib/II期研究在50例不可切除或转移性TNBC患者中评估了SHR-A1811(4.8mg/kg或5.6mg/kg,每3周1次)联合阿得贝利单抗(1200mg,每3周1次)的疗效和安全性。
在Ib期研究(n=8)中,未观察到DLT。4.8mg/kg和5.6mg/kg剂量组的cORR分别为66.7%(2/3)和60.0%(3/5)。II期研究部分纳入了42例未经治疗的TNBC患者,评估4.8mg/kg剂量SHR-A1811。中位随访4.6个月时,39例患者可评估疗效,总体ORR为66.7%(26/39),PD-L1 CPS≥1亚组的ORR为77.8%(21/27)。SHR-A1811联合阿得贝利单抗耐受性良好,未发现新的安全问题。无论HER2或PD-L1表达状态如何,该联合治疗均显示出良好的抗肿瘤活性。
产品:TQB2102
药物靶点+类型:HER2双抗ADC
公司:正大天晴
全球研发赛道排名:2/7
本次ASCO大会,TQB2102有三项研究入选,其中2项为数据披露。
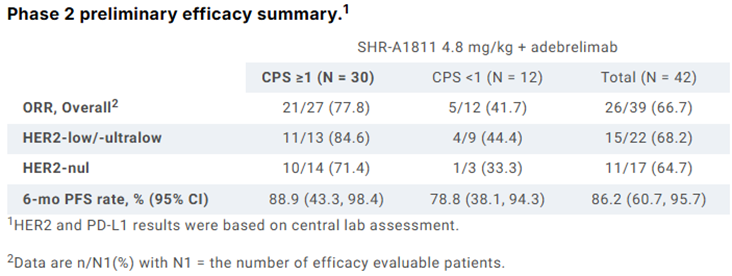
实体瘤I期研究:截至2024年10月1日,181例实体瘤(80例转移性乳腺癌,37例结直肠癌,23例胃癌,41例其它)患者入组接受治疗,其中41例参加剂量递增研究(1.5-9mg/kg),140例参加剂量扩展研究(6mg/kg或7.5mg/kg)。结果显示,中位随访8.15个月时,未出现DLT,也未达到最大耐受剂量(MTD)。在165例可评估疗效的患者中,ORR为41.2%(均为PR)。此外,7例HER2阳性乳腺癌脑转移患者实现PR,其中1例在接受4个周期治疗后实现完全缓解(CR)。
HER2低表达乳腺癌Ib期研究:73例化疗经治患者入组接受单药TQB2102(37例6mg/kg,36例7.5mg/kg)治疗。结果显示,中位随访7.16个月时,总人群ORR为53.4%(39/73),其中6mg/kg剂量组为48.7%,7.5mg/kg剂量组为58.3%;DCR为86.3%(63/73)。HR阳性和HR阴性亚组患者的ORR分别为54.0%(27/50)和52.2%(12/23),其中7.5mg/kg剂量组HR阳性和HR阴性亚组患者的ORR分别为66.7%(14/21)和46.7%(7/15)。在接受过ADC治疗的亚组患者中,ORR为44.4%(4/9)。
安全性方面,TRAE发生率为97.3%(71/73),3级及以上TRAE发生率为41.1%(30/73),SAE发生率为17.8%(13/73)。没有患者出现间质性肺炎。
产品:HLX43
药物靶点+类型:PD-L1 ADC
公司:复宏汉霖
全球研发赛道排名:1/5
本次披露的I期研究分为两个部分。第1部分共纳入了18例对标准治疗无效或不适用的晚期/转移性恶性实体瘤患者,包括12例NSCLC、1例头颈部鳞状细胞癌、1例宫颈鳞状细胞癌、1例胸腺鳞状细胞癌、1例鼻咽癌、1例子宫癌肉瘤、1例小细胞肺癌。结果显示,研究者评估的ORR为31.3%。
第2部分纳入了对标准治疗无效的晚期/转移性NSCLC患者,包括15例鳞状NSCLC和6例非鳞状NSCLC。结果显示,研究者评估的ORR和DCR分别为38.1%和81.0%,其中8例患者(6例鳞状NSCLC和2例非鳞状NSCLC)实现PR。结果提示,HLX43在不同剂量下耐受性良好,并在包括NSCLC在内的标准治疗失败的晚期实体瘤患者中展现出初步疗效。
产品:ozuriftamab vedotin
药物靶点+类型:ROR2 ADC
公司:BioAtla
全球研发赛道排名:1/1
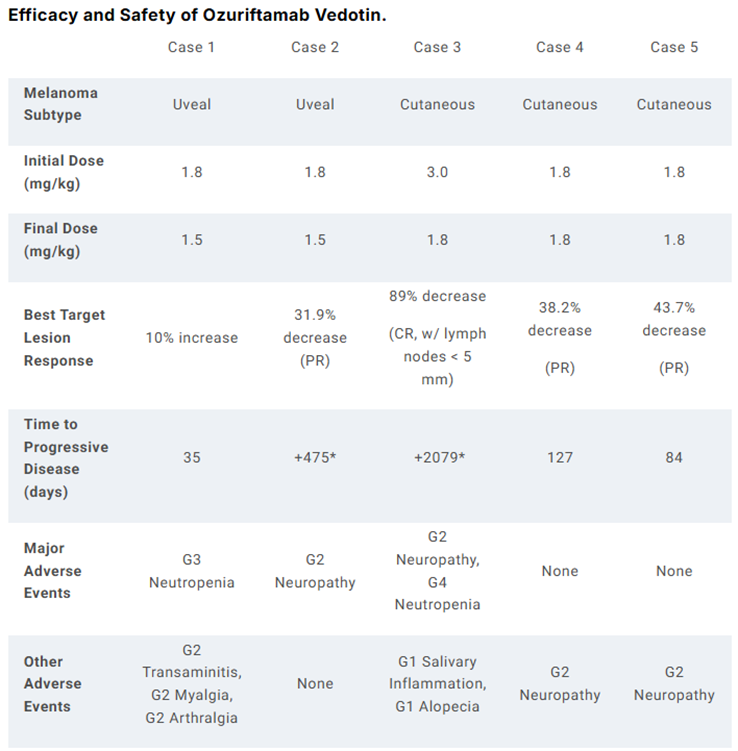
本次ASCO首次公布了ozuriftamab vedotin治疗黑色素瘤的I期研究数据。该研究纳入5例既往接受过长春花生物碱结合位点抑制剂治疗且对所有标准治疗无效的晚期皮肤或葡萄膜黑色素瘤患者。
5例患者中有4例在目标病灶中根据RECIST v1.1标准实现了客观缓解。其中两例患者维持了疾病控制,包括1例患者完全缓解超过5年,1例患者在开始治疗后缓解时间超过1年。没有患者因不良反应而停止治疗。
通过免疫组化(IHC)评估了活检样本中的ROR2表达水平。实现CR的患者的活检样本呈ROR2强阳性。所有其他活检样本显示恶性细胞的ROR2染色低或阴性。
产品:PD-L1V(PF-08046054)
药物靶点+类型:PD-L1 ADC
公司:辉瑞
全球研发赛道排名:2/5
C5851001研究包含一个I期安全性导入队列(Part D)。截至2024年12月20日,共14例PD-L1 CPS≥1且未经治疗的复发性或转移性头颈部鳞状细胞癌(R/M HNSCC)患者入组。
队列1患者(n=8)基于调整后理想体重(AIBW)接受每3周2次的PD-L1V(1.25mg/kg)联合帕博利珠单抗(200mg,每3周一次)治疗。确认安全性后,队列2患者(n=8)基于AIBW接受每3周2次的PD-L1V(1.5mg/kg)联合帕博利珠单抗(200mg,每3周一次)治疗。
疗效方面,14例可评估疗效患者的ORR为50.0%,完全缓解(CR)率21.4%,中位DOR尚未达到。
安全性方面,未观察到DLT。最常见的治疗相关不良事件(TRAE)是疲劳和恶心(各占50.0%)、周围感觉神经病变(35.7%)、腹泻(28.6%)以及贫血、便秘、食欲下降、肌肉痉挛、肺炎和热病(各占14. 3%)。
产品:rinatabart sesutecan(Rina-S)
药物靶点+类型:FRα ADC
公司:普方生物(Genmab)
全球研发赛道排名:3/19
首次披露了I/II期GCT1184-01研究剂量扩展队列B2的数据,评估Rina-S单药在经多线治疗子宫内膜癌(EC)患者中的疗效。截至2024年11月22日,64例经多线治疗EC患者(中位既往治疗线数为3)接受Rina-S治疗,其中100mg/m²组22例,120mg/m²组42例。
中位随访18.7周时,100mg/m²组(n=22)和120mg/m²组(n=33)未经确认的ORR分别为50%(含2例完全缓解)和45.5%,DCR分别为100%和81.8%。100mg/m²组11例缓解者中9例(81.8%)、120mg/m²组15例缓解者中12例(80.0%)仍持续缓解。
安全性方面,各剂量组TEAE谱相似,主要表现为血细胞减少和1-2级胃肠道反应(恶心、呕吐、食欲减退)。3-4级血细胞减少包括中性粒细胞减少(48.4%)、贫血(35.9%)和血小板减少(21.9%)。15.6%患者因TEAE减量,3.1%停药,37.5%发生严重TEAE。120mg/m²组报告1例因合并症引起的5级TEAE(研究者判定),100mg/m²组无致死性TEAE。
产品:SYS6010
药物靶点+类型:EGFR ADC
公司:石药
全球研发赛道排名:2/22
本项首次人体临床试验采用单中心、开放标签、非随机化设计,截至2024年12月31日,共纳入了25例接受过至少一线标准治疗进展的EGFR表达阳性晚期胃肠道肿瘤(18例结直肠癌,7例胃癌)患者,其中12例接受过至少三线治疗,旨在评估SYS6010(3.2mg/kg,每2周1次)联合ATM抑制剂SYH2051(40mg或80mg,每日1次)的安全性、耐受性和初步疗效。
在可评估疗效的6例胃癌患者中,3例达到PR,3例疾病稳定(SD),ORR为50%,DCR为100%,中位PFS约5.8个月(数据未成熟),3例仍在持续治疗中。在18例结直肠癌患者中(KRAS突变型与野生型各9例),初步分析显示KRAS野生型患者中位PFS约4.2个月(数据未成熟)。
安全性方面,常见TRAE包括血液学毒性、胃肠道症状和乏力。3级及以上TRAE发生率为48%(12/25)。未见报告治疗相关死亡事件。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


