《自然·医学》:阿尔茨海默病研究重大进展!跨越60年的研究发现治疗AD的三个时间窗口
来源:奇点糕 2023-08-09 11:49
Johnson团队的这项研究成果让我们对阿尔茨海默病的病理变化有了更深入/清晰的认知。他们认为,针对每一类病理变化开展的治疗干预,在这些病理变化发生之前、发生之时或临近发生之时可能最为成功;因此,根据
众所周知,阿尔茨海默病(AD)的病理变化在症状出现前的几十年就开始了。
然而,除了Aβ和tau蛋白的变化之外,我们对临床前AD的病理变化仍知之甚少,这显然阻碍了AD治疗药物的研发。
今天,埃默里大学医学院Erik C. B. Johnson团队在《自然·医学》上发表的一项重磅研究成果[1],打破了这一困局,让我们对AD发病前数十年前的病理变化有了清晰的认知。
Johnson团队在之前研究的基础上,探索了常染色体显性阿尔茨海默病(ADAD)患者脑脊液在连续60年中的变化情况,发现了AD进展过程中相关蛋白的变化情况。
总体来看,在出现临床症状的30年前,与Aβ斑块相关的SMOC1蛋白就在脑脊液中升高,随后是突触蛋白、代谢蛋白、轴突蛋白和炎症蛋白发生变化,最后是神经分泌蛋白的减少。
在上述研究数据的基础上,Johnson团队认为,至少有三个关键时期可以对阿尔茨海默病进行治疗干预:(1)认知症状出现前30年,Aβ斑块开始形成的时间;(2)认知症状出现前19年,轴突和白质完整性问题发生的时间;(3)认知症状出现前6年,炎症反应开始的时间。

论文首页截图
虽然阿尔茨海默病的临床前阶段很长,但是要研究这个阶段的病理变化非常不易。因为很多有阿尔茨海默病病理特征的人,最终并不会表现出阿尔茨海默病的临床症状。
为了解决这个问题,Johnson团队选择了ADAD这个群体。ADAD表现出家族遗传性,往往携带APP、PSEN1或PSEN2等基因突变,他们的估计发病年数(EYO)可以相对准确地估算出来,因此ADAD相关基因突变的携带者适合作为症状前AD的研究对象。
在本研究中,Johnson团队招募了286个ADAD相关基因突变携带者和184个非携带者,并用选择反应监测质谱(SRM-MS)连续检测他们脑脊液(CFS)中59个AD病理蛋白的变化(从症状前30-40年到症状后20-30年,间隔是0.5年)。与此同时,他们还采用了去年发表的一项研究成果,将AD患者大脑中超8600个蛋白的表达情况分为44个模块[2],用于解释59个蛋白的潜在影响。
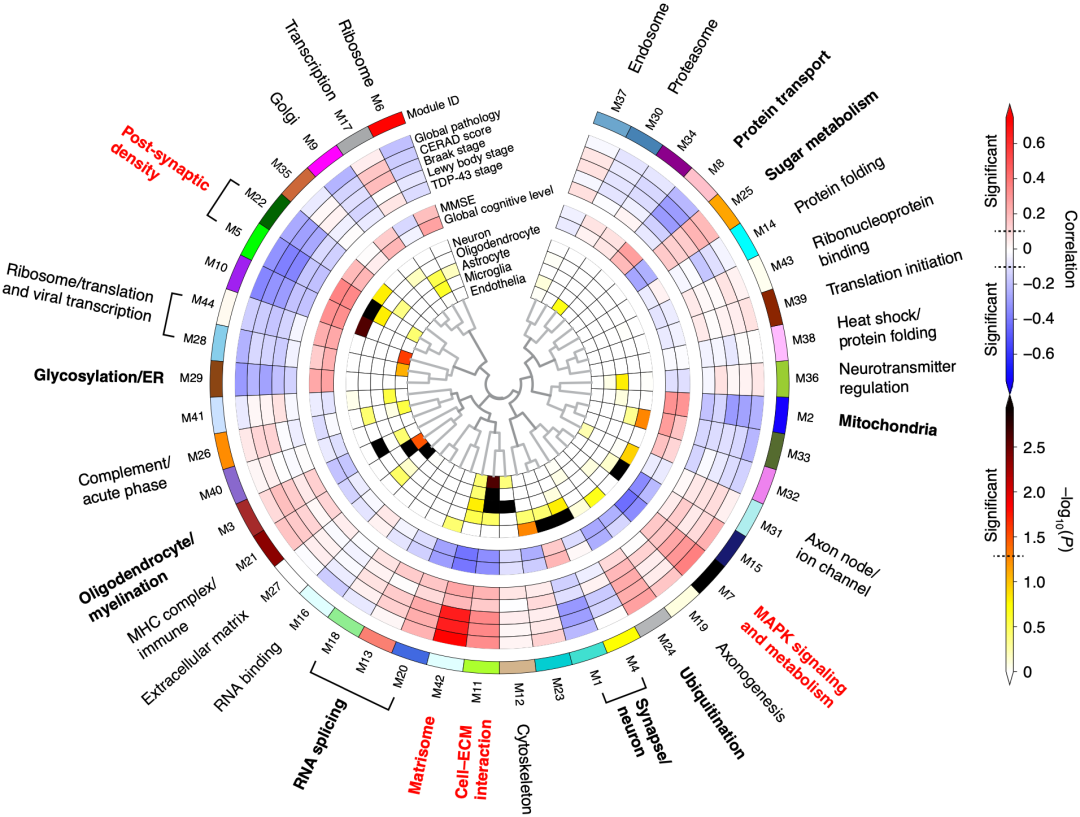
根据AD患者大脑基因表达情况划分的44个功能模块[2]
在Johnson和他的同事看来,只要能将这59个蛋白质与相关模块联系起来,就能够将这些蛋白质的变化与多种不同的AD病理过程联系起来,并估计这些蛋白质生物标志物在疾病过程中的变化时间和方式。
从检测结果来看,在59个蛋白中,有33个在ADAD相关突变携带者和非携带者之间存在差异,其中大多数蛋白质在症状出现之前就发生了变化。
接下来就是研究最重要的部分了,Johnson团队根据这33个蛋白质在AD进程中发生变化的时间,按照先后顺序给它们排了顺序,然后根据它们的影响分成五大类,并解析了每一类变化的特征(如下图所示)。
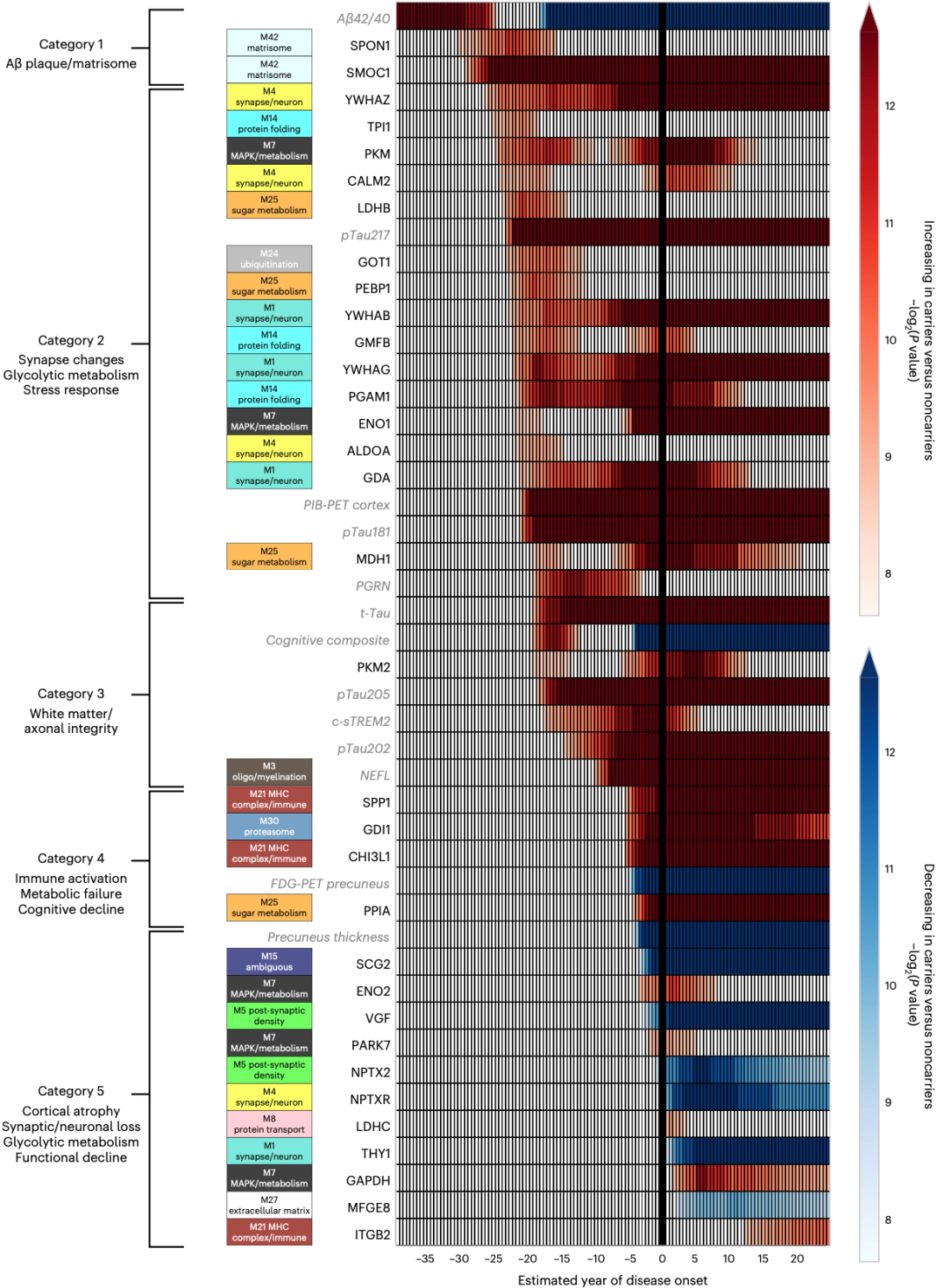
AD进展过程中重要蛋白(深黑色)的变化时间和幅度
咱们先来看第一类(影响Aβ斑块/基质组),也就是上图中最上面的那一类。
从图中可以看出,在症状出现之前的29年,脑脊液中SMOC1这个蛋白的水平就开始升高了,而且在整个病程中持续升高。重要的是,SMOC1水平的升高竟然先于脑脊液中Aβ42或Aβ42/40绝对水平的显著下降,更是早于pTau181和pTau217水平的升高。要知道,脑脊液中Aβ42或Aβ42/40的显著下降与大脑中Aβ斑块的形成有关[3]。这似乎暗示,SMOC1的升高与Aβ斑块升高同时发生,或者更早。
再来看第二类:影响突触变化/糖酵解代谢/应激反应。
这一类包含的蛋白质比较多,例如14-3-3家族的YWHAZ(1433Z)、YWHAB(1433B)和YWHAG(1433G)等。尽管14-3-3蛋白在症状出现前26至22年时显著升高,但它们的水平直到症状前第8年时才开始迅速升高。有意思的是,神经丝轻链(NEFL)大约也是在症状前第8年开始升高的。
另一个值得关注的是影响糖代谢的蛋白变化,这些蛋白的早期升高并不持续,大约在症状出现前17年时达到峰值,随后降到与非携带者相当的水平,直到症状发作前后再次升高。值得注意的是,早期糖代谢变化与其他几个蛋白质标志物(PGRN、GOT1、GMFB和PEBP1)的升高有关。Johnson团队认为,这些变化反映了早期的代偿性神经保护反应。
接下来是第三类影响白质和轴突完整性的蛋白,第四类影响免疫激活/代谢失调/认知能力下降的蛋白,以及第五类影响皮质萎缩/突触和神经元损伤/糖代谢和功能衰退的蛋白。
第三类的变化从症状出现前的19年开始出现,先是总tau(t-Tau)和pTau205水平升高,随后c-sTREM2的可溶性裂解形式(与小胶质细胞活化有关)轻度升高,最后在症状出现前10年NEFL开始升高。第四类变化大约从症状出现前6年开始。第五类的变化已经进入症状阶段,患者开始出现脑萎缩,神经元和神经分泌蛋白也减少。
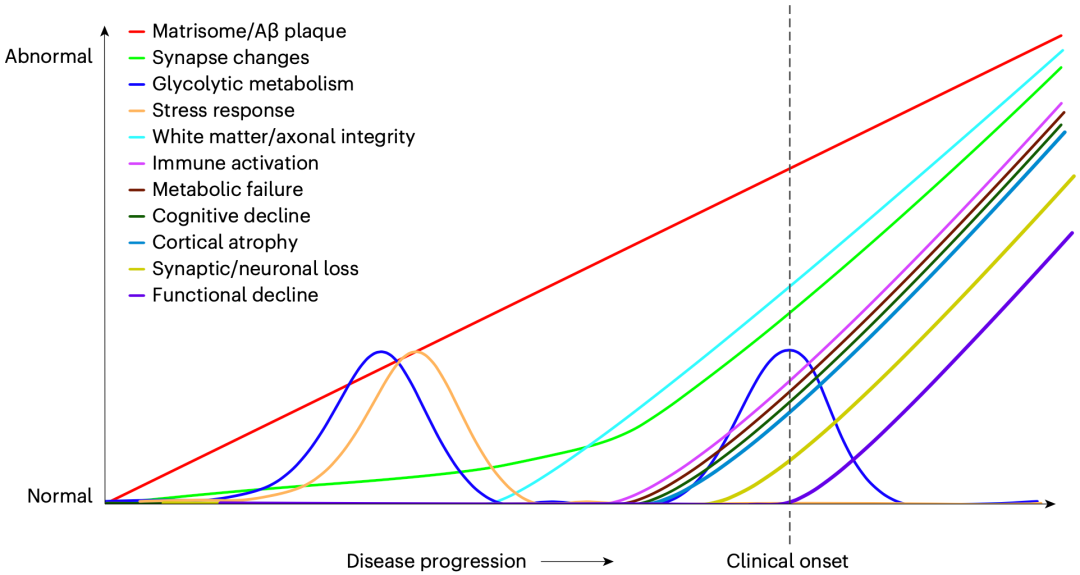
标志物变化的曲线图
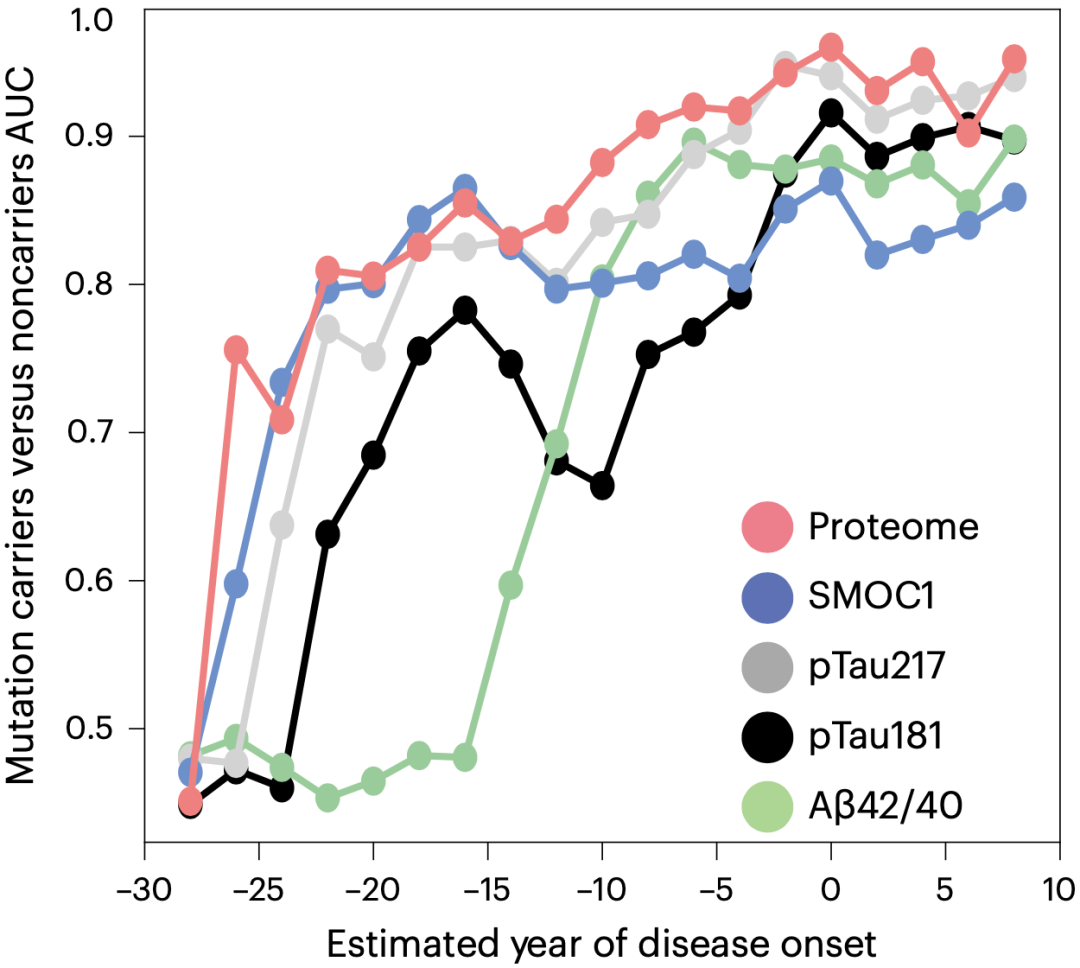
在研究的最后,Johnson团队评估了33个变化蛋白区分ADAD携带者和非携带者的能力。他们发现,与Aβ和tau相比,SMOC1和蛋白质组的表现都更好,尤其是在AD的无症状临床前阶段。这意味着,这些蛋白质组数据对AD的分型和分期非常重要,或可用于指导AD的精准治疗。
总的来说,Johnson团队的这项研究成果让我们对阿尔茨海默病的病理变化有了更深入/清晰的认知。他们认为,针对每一类病理变化开展的治疗干预,在这些病理变化发生之前、发生之时或临近发生之时可能最为成功;因此,根据这项研究成果,至少有三个关键时期(如文章开头所言)可以对阿尔茨海默病进行治疗干预。
除了以上的价值之外,这个研究还指出了一些潜在的治疗靶点。例如,第一类蛋白变化指向的M42基质组蛋白(Aβ是其中之一)之中,除了Aβ之外,可能还潜藏着其他驱动AD的靶点。因此,围绕M42基质组蛋白的研究,有可能找到治疗AD的新靶点。
参考文献:
[1].Johnson, E.C.B., Bian, S., Haque, R.U. et al. Cerebrospinal fluid proteomics define the natural history of autosomal dominant Alzheimer’s disease. Nat Med, 2023. doi:10.1038/s41591-023-02476-4
[2].Johnson ECB, Carter EK, Dammer EB, et al. Large-scale deep multi-layer analysis of Alzheimer's disease brain reveals strong proteomic disease-related changes not observed at the RNA level. Nat Neurosci. 2022;25(2):213-225. doi:10.1038/s41593-021-00999-y
[3].Campbell MR, Ashrafzadeh-Kian S, Petersen RC, et al. P-tau/Aβ42 and Aβ42/40 ratios in CSF are equally predictive of amyloid PET status. Alzheimers Dement (Amst). 2021;13(1):e12190. doi:10.1002/dad2.12190
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


