BBI:东南大学附属中大医院团队发现睡不好伤大脑的原因!
来源:奇点糕 2023-01-04 10:05
本研究证实了肠道菌群和NLRP3炎症小体是慢性SD导致认知功能障碍的关键环节,阐明了慢性SD损伤认知功能的新机制,揭示了以肠道菌群和NLRP3炎症小体为靶点的基因和药物干预作为预防认知损伤的新策略
睡眠是健康和生命不可或缺的生理需求,在维持免疫、代谢、胃肠、心血管和中枢神经系统的稳态中起着至关重要的作用[1]。然而,在繁忙的现代社会,睡眠不足或睡眠障碍已经成为全球公共卫生流行疾病。
根据世界卫生组织的统计数据显示,全球睡眠障碍率已接近30%;中国成人睡眠障碍发生率更高达40%,超过3亿国人存在睡眠障碍,并且这一数字还在逐年攀升 [2,3]。2022年中国国民健康睡眠调查显示:从1985-2018年,中国成人睡眠时间小于6小时在逐年递增;44%的年轻人每天熬夜至零点以后;42%的老年人入睡困难,失眠率高发[4]。也有越来越多的证据表明,睡眠减少可导致认知功能障碍并增加阿尔茨海默病(AD)的风险[5, 6]。
尽管无数事实表明,睡眠问题是轻度认知障碍、临床前AD和AD发展的危险因素,但睡眠剥夺(SD,sleep deprivation)影响认知功能的潜在机制仍需进一步挖掘。
近日,东南大学附属中大医院神经内科任庆国教授团队在国际著名期刊Brain, behavior, and immunity在线发表重要研究成果,他们发现,慢性SD可导致肠道菌群失调,从而激活肠道和大脑NLRP3炎性小体,破坏肠道和血脑屏障,触发肠道和中枢神经系统(CNS)炎症反应,进而损害认知功能。
该研究首次提出NLRP3炎症小体作为微生物-肠-脑轴中的关键调节因子,在SD引起的认知障碍中发挥重要作用,可能成为预防认知损伤和AD的潜在靶点。

论文首页截图
NLRP3是目前发现的功能最明确的炎症小体。为了探讨炎症是否在SD小鼠模型中发挥作用,研究者首先检测SD对小鼠脑内NLRP3炎症小体活性的影响。
他们发现,SD小鼠前额叶皮质和海马中IBA-1、NLRP3炎症小体和 IL-1β表达显著增加,海马区小胶质细胞明显激活。研究者进一步发现,SD小鼠前额叶皮质和海马中代表血脑屏障的标记物,包括Occludin、ZO-1和Claudin-5表达显著降低,说明慢性SD破坏了小鼠血脑屏障。
为了探索SD对肠道菌群的影响,研究者通过16S rRNA基因测序,发现慢性SD小鼠肠道菌群失调,表现为肠道菌群组成的显著改变,包括 Alpha-多态性降低和Beta-多态性改变。同时,慢性SD破坏肠道屏障,增加外周血炎症因子水平,包括LPS,IL-1β和IL-6。
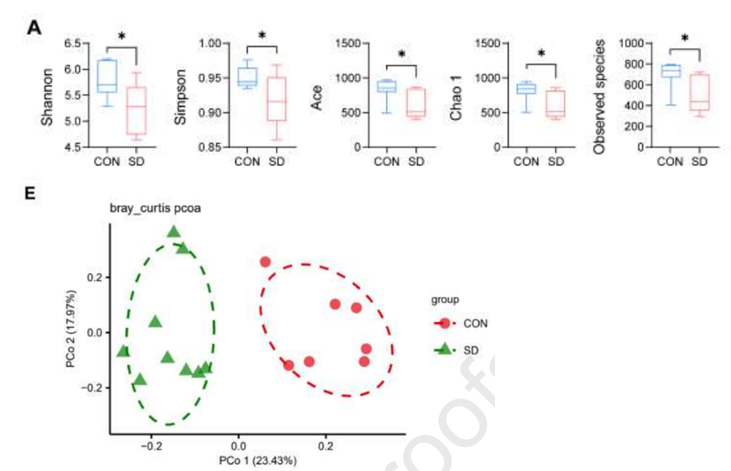
慢性SD小鼠肠道菌群失调。
研究者通过移植“SD菌群”几乎可以模拟所有慢性SD引起的小鼠行为学变化和病理改变,包括认知功能下降,肠粘膜屏障和血脑屏障破坏,肠道和海马NLRP3炎症小体增加。
有趣的是,当研究者敲除小鼠NLRP3基因,可逆转慢性SD引起的认知功能下降,包括水迷宫和新物体识别测试反应的小鼠学习记忆能力的改善。同时,与野生型SD小鼠相比,NLRP3基因敲除小鼠在慢性SD后肠道和血脑屏障功能损伤减轻,肠道和中枢神经系统NLRP3炎症小体和IL-1β水平更低。
 NLRP3基因敲除改善SD小鼠认知功能。
NLRP3基因敲除改善SD小鼠认知功能。
最后,研究者运用AAV病毒分别下调肠道和海马区NLRP3炎症小体的表达。他们发现,在慢性SD小鼠中,下调肠道中NLRP3炎症小体可以改善肠粘膜屏障功能,降低外周血炎性因子的水平,并改善SD小鼠认知功能。同样,下调海马区的NLRP3可以抑制神经炎症,改善慢性SD引起的突触损伤和认知障碍。
该研究表明,肠道菌群失调是慢性SD的引起认知功能障碍的始动因素。肠道微生物可通过激活肠道内NLRP3炎症小体导致肠道屏障破坏,增加外周血炎症水平,并进一步通过受损的血脑屏障激活中枢神经系统中NLRP3炎性小体,导致神经突触损伤和认知功能障碍。
该研究揭示了在慢性SD中,肠-脑交互如何影响认知功能。研究明确了肠道菌群在慢性SD中的损伤作用,并强调了NLRP3炎症小体作为微生物-肠-炎症-脑中的核心介质,在慢性SD诱导的认知功能障碍中发挥的重要作用。
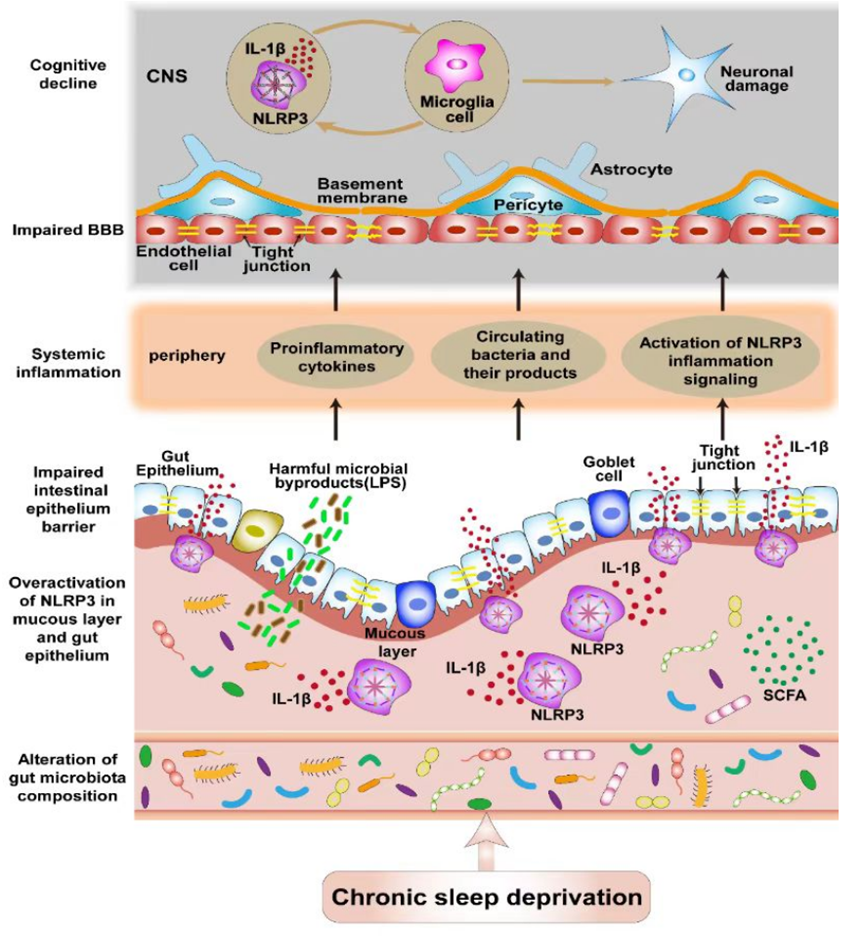
研究机制图。
总的来说,本研究证实了肠道菌群和NLRP3炎症小体是慢性SD导致认知功能障碍的关键环节,阐明了慢性SD损伤认知功能的新机制,揭示了以肠道菌群和NLRP3炎症小体为靶点的基因和药物干预作为预防认知损伤的新策略,对降低慢性SD导致认知障碍风险以及防治AD等神经退行性疾病提供新的思路。
参考文献
[1] E. Tobaldini, E.M. Fiorelli, M. Solbiati, G. Costantino, L. Nobili, N. Montano, Short sleep duration and cardiometabolic risk: from pathophysiology to clinical evidence, Nat Rev Cardiol 16(4) (2019) 213-224.
[2] Y. Liu, A.G. Wheaton, D.P. Chapman, T.J. Cunningham, H. Lu, J.B. Croft, Prevalence of Healthy Sleep Duration among Adults--United States, 2014, MMWR Morb Mortal Wkly Rep 65(6) (2016) 137-41.
[3] T. Svensson, E. Saito, A.K. Svensson, O. Melander, M. Orho-Melander, M. Mimura, S. Rahman, N. Sawada, W.P. Koh, X.O. Shu, I. Tsuji, S. Kanemura, S.K. Park, C. Nagata, S. Tsugane, H. Cai, J.M. Yuan, S. Matsuyama, Y. Sugawara, K. Wada, K.Y. Yoo, K.S. Chia, P. Boffetta, H. Ahsan, W. Zheng, D. Kang, J.D. Potter, M. Inoue, Association of Sleep Duration With All- and Major-Cause Mortality Among Adults in Japan, China, Singapore, and Korea, JAMA Netw Open 4(9) (2021) e2122837.
[4] E.S. Ford, T.J. Cunningham, J.B. Croft, Trends in Self-Reported Sleep Duration among US Adults from 1985 to 2012, Sleep 38(5) (2015) 829-32.
[5] M.A. Short, M.W.L. Chee, Adolescent sleep restriction effects on cognition and mood, Prog Brain Res 246 (2019) 55-71.
[6] L. Shi, S.J. Chen, M.Y. Ma, Y.P. Bao, Y. Han, Y.M. Wang, J. Shi, M.V. Vitiello, L. Lu, Sleep disturbances increase the risk of dementia: A systematic review and meta-analysis, Sleep Med Rev 40 (2018) 4-16.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


