Adv Sci:光激活化合物有望克服癌细胞药物耐受性的产生
来源:生物谷原创 2025-02-14 09:56
本文研究中,研究人员利用质谱、活细胞成像和特殊的模型复合物进行了体外验证,后期研究人员还需要进一步验证这种精确溶酶体氧化性策略的抗肿瘤功效。
自噬(autophagy)是一种重要的质量控制机制,其能通过溶酶体与自噬体的融合来降解受损的细胞组分,然而,自噬水平的升高也会促进癌细胞对药物的耐受性并提高其存活率;通过氧化性压力来下调自噬或许能作为一种临床上有希望的策略来对抗癌细胞的耐药性,但在自噬蛋白中精确控制氧化性压力对于科学家们而言还具有一定的挑战性。
近日,一篇发表在国际杂志Advanced Science上题为“Rational Design of Biocompatible Ir(III) Photosensitizer to Overcome Drug-Resistant Cancer via Oxidative Autophagy Inhibition”的研究报告中,来自韩国蔚山科学技术院等机构的科学家们通过研究开发了一种创新性的技术,其能利用光来消除耐药的癌细胞;文章中,研究人员开发了一种能抑制癌细胞自噬过程的光反应化合物,癌细胞自噬是其抵御抗癌疗法的关键机制之一。
众所周知,癌细胞具有非凡的适应性,这或许就对于开发有效的疗法带来了重大挑战,癌细胞的生存策略之一就是自噬,即细胞能降解并回收废物;这一机制不仅能促进癌细胞排出抗癌药物,而且还能通过重新利用废弃物质来为癌细胞提供能量,从而躲避免疫检测。为了对抗这种自噬过程,研究人员设计出了一种光反应化合物,其能整合吗啉(morpholine)和铱(iridium),吗啉能选择性地靶向作用细胞溶酶体,而溶酶体是自噬发生的细胞器,同时铱在暴露于光下能激活并诱导氧化性损伤发生。
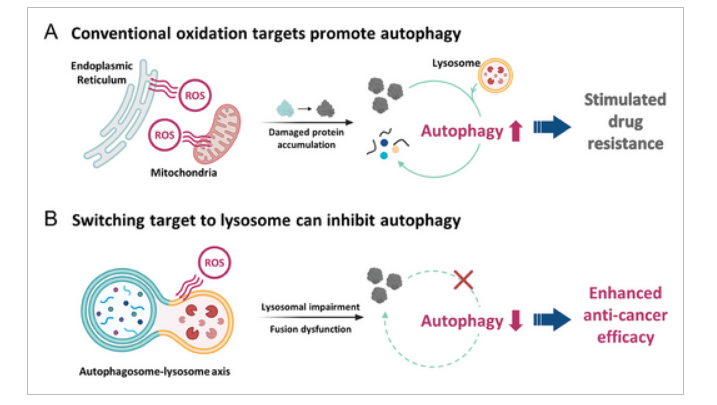
活性氧自由基(ROS)在自噬过程中的双重作用示意图
在临床前研究中,当这种光反应化合物被给予携带耐药胰腺癌的小鼠随后暴露在红外光下时,结果是非常惊人的,这种耐药胰腺癌组织就会明显减少,而且研究人员仅在7天内就观察到了肿瘤被完全根除了。分析结果表明,在光激活下,这种化合物能破坏溶酶体膜并阻断其与自噬体的融合,而自噬体负责分离细胞废物,研究人员表示,他们计划调查参与氧化性损伤过程的其它蛋白。
此外,研究人员还利用动物模型进行了毒性和抗癌效能的评估,研究者Kwon表示,这种能靶向作用自噬过程的突破性方法能显著增强能表现出药物耐受性的主要难治性癌症的治疗选择,目前我们也在深入探索将现有抗癌制剂与吉西他滨结合的联合疗法的治疗疗效。
综上,本文研究中,研究人员利用质谱、活细胞成像和特殊的模型复合物进行了体外验证,后期研究人员还需要进一步验证这种精确溶酶体氧化性策略的抗肿瘤功效,本文研究有望激发时空活性氧自由基控制对自噬过程复杂调节的治疗性应用。(生物谷Bioon.com)
参考文献:
Mingyu Park, Jung Seung Nam, Taehyun Kim, et al. Rational Design of Biocompatible Ir(III) Photosensitizer to Overcome Drug‐Resistant Cancer via Oxidative Autophagy Inhibition, Advanced Science (2024). DOI:10.1002/advs.202407236
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


