《科学》上发表长文首次揭示植物TNL类抗病蛋白激活的分子机制
来源:清华大学 2020-12-11 17:42
清华大学生命学院柴继杰课题组和德国马克斯-普朗克植物育种研究所的Jane Parker课题组、Paul Schulze-Lefert课题组合作,近日发文首次报道了植物TNL类抗病蛋白RPP1直接识别并结合效应蛋白ATR1、形成抗病小体并作为全酶催化NAD+水解的分子机制。该研究促进了TNL下游免疫通路信号传递机制的研究,为
清华大学生命学院柴继杰课题组和德国马克斯-普朗克植物育种研究所的Jane Parker课题组、Paul Schulze-Lefert课题组合作,近日发文首次报道了植物TNL类抗病蛋白RPP1直接识别并结合效应蛋白ATR1、形成抗病小体并作为全酶催化NAD+水解的分子机制。该研究促进了TNL下游免疫通路信号传递机制的研究,为理解植物TNL类抗病蛋白活化机制提供了范式。更重要的是,该研究将为抗病作物的育种研究提供理论基础和直接模型,有望减少农业上化学农药的使用。
该研究于2020年12月4日以研究长文的形式在《科学》上在线发表,题为“病原微生物直接诱导NLR免疫受体复合物组装形成全酶”(Direct pathogen-induced assembly of an NLR immune receptor complex to form a holoenzyme)。此外,《科学》同期还配发了题为“免疫受体形成酶”(Enzyme formation by immune receptors)的评论文章。
柴继杰课题组一直致力于NLR家族受体的作用机制。继此前揭示了CNL类受体ZAR1的自抑制与活化机制后,此次又首次报道了TNL受体RPP1配体识别以及活化的分子机制。作为植物两大类NLR受体CNL和TNL的代表,ZAR1与RPP1的研究成果是植物抗病蛋白研究领域数十年来一直期待的重大突破。
植物在与病原微生物长期共同进化的过程中逐渐进化出先天免疫机制,用来抵抗病原微生物的侵害。其中一类重要组成部分是效应蛋白引起的先天免疫(Effector-Triggered-Immunity,ETI)。NLR(Nucleotide-binding domain and leucine-rich repeat containing receptor)是调节ETI的一类主要受体蛋白。根据其N端结构域的不同,NLR主要分为两类:CNL(CC-NB-LRR)和TNL(TIR-NB-LRR)。这两类受体蛋白都可以直接或者间接地识别病原菌效应蛋白进而引起ETI。柴继杰实验室去年的研究成果表明,CNL例如来自拟南芥的CNL抗病蛋白ZAR1,识别效应蛋白后可以形成抗病小体(Resistosome)。ZAR1抗病小体可能作为离子通道或者转运通道引起ETI。相比CNL,TNL的作用机制更为复杂。TNL的N端TIR结构域具有NAD+水解酶活性(NADase)。该活性被认为用以产生第二信使信号,激活下游的EDS1、NRG1等免疫通路。目前对于TNL信号传导还有很多问题有待回答。例如TNL如何识别效应蛋白?TNL是否可以形成抗病小体?识别效应蛋白对TIR的NAD+水解活性是否有调节作用?
拟南芥的RPP1是TNL类抗病蛋白的典型代表,主要由N端的TIR结构域、中间的NOD(Nucleotide binding oligomerization domain)结构域以及C端的亮氨酸重复(Leucine rich repeat,LRR)结构域组成。ATR1是植物病原菌Hyaloperonospora arabidopsis分泌的一类效应蛋白,在病原菌侵染植物叶片的过程中分泌到植物叶片内,被拟南芥的RPP1识别后,可以引起ETI。
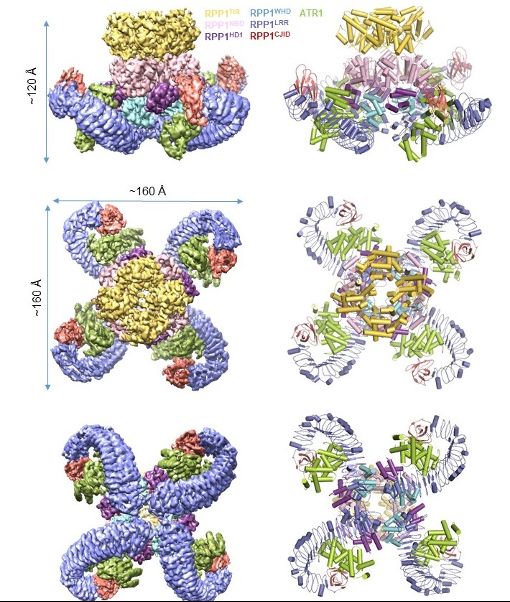
ATR1诱导RPP1抗病小体的形成
该研究利用杆状病毒表达系统在昆虫(Spodoptera frugiperda)细胞里重组共表达了TNL类抗病蛋白RPP1与其效应蛋白ATR1,通过串联纯化的方法得到了高纯度的激活状态RPP1-ATR1复合物,命名为RPP1抗病小体(RPP1 resistosome)。通过冷冻电镜单颗粒重构技术,成功解析了RPP1结合ATR1形成四聚体激活状态的冷冻电镜结构,分辨率为3.16 ?(图1),并结合遗传学和生物化学的手段进一步阐释了它发挥功能的具体机制。
RPP1直接识别ATR1的结构基础
电镜结构显示RPP1的LRR结构域直接参与ATR1的结合。除此之外,结构比较发现RPP1的C末端有一个新的结构域C-JID(C-terminal jell roll and Ig-like domain)也直接参与ATR1的直接识别。进一步分析表明,C-JID几乎存在于所有的TNL中,暗示该结构域可能对TNL识别配体具有广谱作用。RPP1识别ATR1引起自身构象变化,从而解除分子内自抑制,形成四聚体的激活状态。该结构为NLR直接识别效应蛋白的假说提供了有力证据。
RPP1抗病小体作为全酶催化NAD+的水解
生化分析表明RPP1抗病小体的形成可以极大地促进NAD+水解活性,并且二价金属离子如镁离子以及钙离子可以进一步促进该活性。结构分析显示了RPP1抗病小体作为一个全酶催化NAD+水解的机制。有别于其它C4对称性的结构域,抗病小体中的4个TIR结构域采用C2对称性,即两个TIR结构域通过类平移对称形成头对尾的二聚体,在此基础上两个二聚体再通过C2对称形成四聚体。多方面证据支持RPP1抗病小体中的两个头对尾的二聚TIR作为完整的NADase催化NAD+水解。首先,一个ATP分子结合在一个头对尾的二聚TIR中;其次,结构比较显示该ATP分子与TIR的另外一种底物NADP+具有相似的结合位点;最后,BB-loop对于形成头对尾的TIR二聚体具有重要作用,而突变该loop上的关键氨基酸极大降低RPP1抗病小体的NAD+水解活性以及ATR1诱导的ETI活性。
RPP1抗病小体结合ADP,而非ATP/dATP
关于NLR受体活化,目前一个普遍被接受的观点是配体结合后促进ATP/dATP交换抑制态中的ADP分子(结合于NOD结构域),从而引起NLR的寡聚化。然而令人吃惊的是,RPP1抗病小体的NOD结构域结合的是ADP,而非ZAR1抗病小体中的ATP/dATP。蛋白质序列分析表明,ZAR1利用CNL高度保守 “TTR” 基序中的R(精氨酸)与ATP/dATP的γ-磷酸基团结合,从而稳定其激活构象。生化以及遗传数据表明该精氨酸对ZAR1抗病小体功能具有关键作用。但是该基序中R在RPP1以及其它很多TNL发生了突变,这些突变是否暗示这一类TNL活化时都结合ADP ?以及它们选择结合ADP而非ATP/dATP的生物学意义尚不清楚,值得将来进一步研究。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


