Science子刊:中山大学廖雯婷团队等揭示KRAS突变驱动结直肠癌免疫逃逸新机制
来源:生物探索 2024-10-10 13:42
这项研究表明KRAS通过降低DDX60表达来破坏dsRNA稳态和病毒拟态效应,从而驱动结直肠癌免疫逃逸。
中山大学附属肿瘤医院廖雯婷团队联合黄慧琳及宋立兵团队,在 Science 子刊 Science Immunology 上发表了题为:Oncogenic KRAS drives immunosuppression of colorectal cancer by impairing DDX60-mediated dsRNA accumulation and viral mimicry 的研究论文。
该研究揭示了癌基因KRAS破坏结直肠癌细胞内源性dsRNA稳态,扰乱“病毒拟态”效应,从而推动结直肠癌的免疫逃逸机制。这一发现为克服结直肠癌免疫治疗耐药性提供了新的思路。

癌基因KRAS的激活性突变在超过40%的结直肠癌中出现,是促进肿瘤免疫逃逸的关键因素。廖雯婷团队此前在发表于 Cancer Cell 的研究(Cancer Cell. 2019 Apr 15;35(4):559-572.e7)中利用转移性结直肠癌转基因小鼠模型(iKAP)揭示了KRAS突变通过抑制结直肠癌细胞的干扰素(IFN)反应来诱导免疫抑制微环境,从而导致免疫检查点耐药。在该研究的延续性工作中,团队继续利用iKAP模型深入探讨了KRAS抑制IFN反应的机制。iKAP模型中具有可诱导的KRASG12D突变,并通过强力霉素(Dox)实现对Apc和Trp53基因的条件性失活。
研究团队采用多种经典双链RNA(dsRNA)检测方法,包括J2-免疫荧光染色、J2-免疫共沉淀结合dsRNA免疫印迹、J2抗体免疫共沉淀结合dsRNA RT-PCR,以及dsRNA提取结合RT-PCR,发现KRAS突变显著降低了结直肠癌细胞内源性dsRNA的丰度,而抑制KRAS突变活性则显著增加了细胞内dsRNA的水平。这些dsRNA主要来源于基因组的转座元件(TE)、内源性逆转录病毒(ERV)以及线粒体基因。
进一步研究表明,KRAS突变并不影响这些基因序列的转录,而是通过降低转录后环节中dsRNA的半衰期来实现降低dsRNA丰度的。细胞内dsRNA可被RNA诱导的沉默复合体(RNA-Induced Silencing Complex,RISC)降解。研究团队还发现,KRAS突变不改变RISC关键组分DICER和AGO2的表达;敲除AGO2能显著上调KRAS突变细胞中dsRNA总量,提示KRAS突变可能通过增强RISC介导的dsRNA降解来降低肿瘤细胞内的dsRNA水平。
此外,研究团队还发现,KRAS突变的结直肠癌细胞对dsRNA的响应能力大大降低。这种能力的减弱意味着这些细胞无法有效启动抗病毒免疫反应,其结果是干扰素刺激基因(ISG)的表达及MHC-I分子的抗原提呈功能受到抑制。通过使用合成的dsRNA类似物poly (I:C)进行实验,研究团队观察到,在KRAS野生型细胞中,poly (I:C)能够显著提升IFN反应和MHC-I分子的抗原提呈功能。然而,在KRASG12D突变型结直肠癌细胞中,这些反应被削弱。当RIG-I样受体(RLR)如RIG-I和MDA5识别并结合胞内病毒RNA后,这些受体的信号被传递到MAVS,导致MAVS在线粒体膜上发生聚集。在KRAS野生型细胞中,poly (I:C)处理可引起显著的MAVs聚集;而在KRAS突变的细胞中,poly (I:C)处理引起的MAVS聚集显著低于KRAS野生型细胞。这些实验结果表明KRAS突变影响RLR/MAVS通路对dsRNA的响应能力,这一过程对于有效的免疫应答至关重要。
RNA结合蛋白(RBP)在保护RNA不被降解方面发挥着关键作用。它们通过多种机制影响RNA的命运,从而在细胞内的RNA稳态和基因表达调控中起核心作用。研究人员猜想,KRAS突变可能通过影响某种关键的RBP来调控dsRNA的稳定性。通过整合结直肠癌遗传学特征和表达谱分析,DDX60被确定为可能参与维持dsRNA稳定性的候选 RBP。结直肠癌中DDX60具有5%左右的缺失突变,且与KRAS突变呈互斥关系。KRAS突变显著抑制DDX60的表达。
团队之前的研究(Cancer Cell. 2019 Apr 15;35(4):559-572.e7)数据表明,KRAS突变型结直肠癌中,JAK–STAT3信号通路显著下调。STAT3 是IFN-α/β反应和抗病毒基因表达的关键转录因子,其活性依赖于GSK3β介导的磷酸化。由于KRAS/AKT信号能够通过磷酸化抑制GSK3β的激酶活性,研究团队推测,KRAS突变可能通过AKT-GSK3β-STAT3通路减少DDX60的表达。通过Western Blotting实验,证实抑制KRAS活性或使用AKT抑制剂能显著上调p-STAT3(Tyr705)和DDX60的表达。进一步通过CUT&Tag技术,明确了STAT3对DDX60的转录激活作用。这些数据证实,KRAS突变通过激活AKT-GSK3β通路,降低STAT3磷酸化水平,从而下调DDX60的表达。
DDX60具有dsRNA结合能力和RNA解旋酶活性,但其K791A位点突变会削弱这些活性。然而,DDX60 对 dsRNA 稳定性的影响尚不明确。为探索DDX60在dsRNA稳定性中的作用,研究团队在KRAS突变型细胞中,构建了稳定过表达DDX60全长、解旋酶结构域及其突变体的细胞株,发现过表达DDX60全长及其解旋酶结构域能显著恢复KRAS突变细胞中dsRNA丰度,并延长dsRNA半衰期,表明了DDX60在结直肠癌细胞中通过增强dsRNA稳定性来维持其稳态的关键作用。进一步通过RNA免疫共沉淀(RNA Immunoprecipitation)实验证明,DDX60可以与DICER竞争性结合dsRNA,从而避免dsRNA被RISC降解。
接下来,研究团队探讨了DDX60在调控抗肿瘤免疫中的作用,发现过表达DDX60在KRAS突变细胞中显著激活了内源性IFN响应,促进MHC-I上调,并增强了卵清蛋白(OVA)257–264(SIINFEKL)肽的呈递能力。此外,过表达DDX60显著抑制了C57BL/6J小鼠中MC38K肿瘤的生长,然而在裸鼠中无此效果。同时,过表达DDX60增加了小鼠肿瘤中T细胞和CD8+ T细胞的浸润。相反,敲低DDX60则消除了IFN响应和抗原呈递能力,并在体内导致MC38肿瘤生长增加,同时减少了肿瘤内T细胞浸润。这些结果表明,DDX60通过诱导病毒拟态效应促进抗肿瘤免疫浸润,其生物学作用依赖于功能性免疫系统。
DDX60在诱导病毒拟态效应方面的作用提示其可能与免疫检查点抑制剂协同增效。在抗PD-1和抗CTLA-4治疗研究中,过表达全长DDX60或其解旋酶域的MC38K肿瘤相较于对照组表现出明显的生长减缓。鉴于解旋酶结构域在dsRNA积累和病毒模拟上的效果与全长DDX60相似,研究团队设计了一种治疗性重组腺相关病毒9型(AAV9)载体,携带DDX60解旋酶结构域,称为AAV-解旋酶。AAV-解旋酶与抗PD-1或抗CTLA-4治疗联合使用,显著抑制肿瘤生长并提高生存率。这些实验结果表明,DDX60的表达可增强过表达KRASG12D的结直肠癌细胞对免疫检查点抑制剂的反应。
此外,为了验证这些效应在人类结直肠癌中的适用性,研究团队使用了肿瘤细胞和外周血单个核细胞(PBMC)与活化T细胞的共培养系统。他们使用了MSI-H细胞系HCT116和MSS细胞系SW620,二者均具有致癌KRAS突变,且DDX60低表达。实验结果显示,DDX60的过表达或KRAS的敲低均显著增强了两种细胞系对抗PD-1疗法的反应。这表明,过表达DDX60或使用KRAS抑制剂能增强MSS和MSI-H 结直肠癌对免疫检查点疗法的敏感性。
研究团队为了验证这些效应在人类结直肠癌中的适用性,构建了肿瘤细胞和外周血单个核细胞(PBMC)以及活化T细胞的共培养系统,使用了MSI-H类型细胞HCT116和MSS类型细胞SW620,这两者均具有KRAS突变且DDX60表达较低。实验结果显示,DDX60的过表达或KRAS的敲低显著提高了两种细胞系对抗PD-1疗法的响应。这表明,过表达DDX60或使用KRAS抑制剂可以增强MSS和MSI-H结直肠癌对免疫检查点疗法的敏感性。
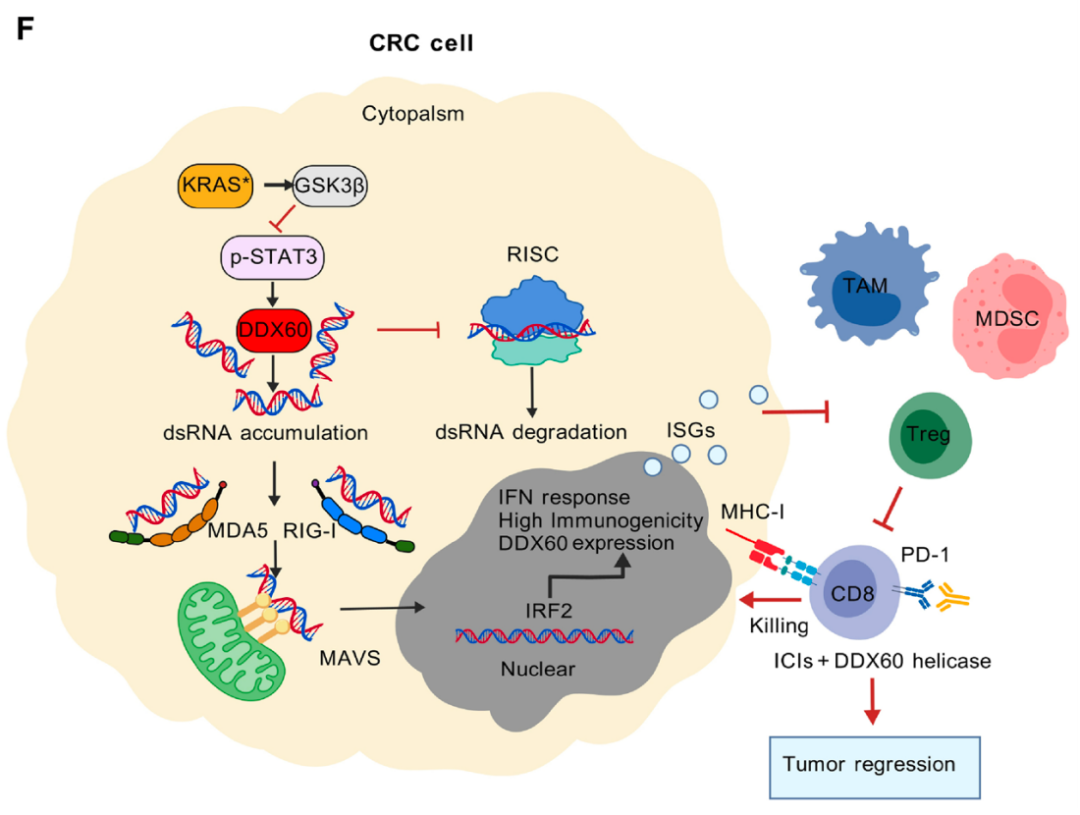
综上所述,这项研究表明KRAS通过降低DDX60表达来破坏dsRNA稳态和病毒拟态效应,从而驱动结直肠癌免疫逃逸。KRAS参与AKT-GSK3β信号传导以抑制STAT3磷酸化,从而抑制由p-STAT3介导的DDX60转录。靶向KRAS或者补充DDX60可以通过激活病毒拟态和天然免疫来释放治疗优势,从而增强免疫检查点治疗的效果。
中山大学附属肿瘤医院廖雯婷研究员、黄慧琳研究员和宋立兵研究员为论文共同通讯作者,博士研究生周仪、张亚欣、李明周、明天为论文共同第一作者。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


