来自麻雀的逆转录转座子可将DNA插入人类基因组安全港,为更安全的基因治疗奠定基础
来源:生物世界 2024-02-27 16:10
研究团队开发了一种新型基因插入技术——“精确RNA介导的转基因插入”(PRINT)。
加州大学伯克利分校 Kathleen Collins 团队在 Nature Biotechnology 期刊发表了题为:Harnessing eukaryotic retroelement proteins for transgene insertion into human safe-harbor loci 的研究论文。
该研究利用在鸟类中发现的逆转录转座子R2,开发了一种精确RNA介导的转基因插入技术——PRINT,为基因治疗带来了更大的希望。这项新技术可以将基因定向插入整合到人类基因组的“安全港”中,而不会带来破坏基因功能或导致癌症等潜在风险。

基因治疗与逆转录转座子
基因治疗的兴起为治疗人类遗传病带来了希望,其中基于CRISPR-Cas系统的基因编辑疗法表现出色。然而,这类基因疗法通过DNA双链断裂和修复进行转基因的插入整合,这可能导致额外的基因突变风险,甚至诱发癌症。
近期获得批准的治疗镰状细胞病和β-地中海贫血的CRISPR-Cas9基因编辑疗法表明,基因编辑工具在通过敲除基因来治疗遗传性疾病方面可以做得很好,但在将完整的基因插入人类基因组以替代有缺陷或有害的基因,仍然有待突破。
因此,理想的基因疗法应当在基因组的“安全港”位点稳健地进行基因插入。逆转录转座子是人类基因组中最丰富的一类可移动遗传元件(MGE),主要以LINE-1和SINE元件为代表。逆转录转座子表现出精细的插入位点特异性,有利于保护宿主基因组免受插入突变,因此是基因疗法的优良载体。
转座子,又被称为跳跃基因,是基因组中一类特殊的DNA,它可以改变自己在基因组中的位置,有时会产生或逆转突变,从而改变细胞的基因特性和基因组大小。转座子构成了人类基因组的很大一部分——大约40%的人类基因组由转座子组成,但这些转座子的绝大多数都是残缺的、无功能的,即所谓的“垃圾DNA”。
在这项发表于 Nature Biotechnology 的研究中,研究团队开发了一种新型基因插入技术——“精确RNA介导的转基因插入”(PRINT)。该技术利用在鸟类中发现的“垃圾DNA”——逆转录转座子R2,可在不影响其他基因的情况下,有效地将外源基因安全插入基因组。
变废为宝:彼之垃圾,吾之利器
许多遗传性疾病,例如囊性纤维化和血友病,都是由单基因突变引起的,但是基因内部的不同区域突变会导致不同的亚型,虽然患者在病症上十分相似,但不同亚型的基因疗法是不同的,需要根据患者的基因突变信息进行定制。相比之下,PRINT可以将正确的、完整的基因替换到基因组中,适用于所有该基因发生突变的患者,使得每个病人的身体都能产生正常的蛋白质,而不管他们的突变是否相同。
因此,许多研究团队和生物技术公司正在研究利用转座子和反转录转座子插入基因进行基因治疗,其中一种流行的逆转录转座子是LINE-1,它可以复制自身和一些搭便车的邻近基因,覆盖了大约30%的人类基因组。
然而,去年12月,Kathleen Collins 等人在 Nature 期刊发表论文【2】,解析了LINE-1表达的全长ORF2蛋白的结构,并揭示了其在人类基因组中复制和转移的机制。然而,这项研究也清楚地表明,LINE-1反转录转座子蛋白很难安全有效地将转基因插入人类基因组中。

值得一提的是,之前的研究表明,插入基因组中重复的核糖体RNA编码区域(rDNA)的基因可以正常表达,这提示了一个与众不同的逆转录转座子——逆转录转座子R2,它可以选择性地插入28S rRNA基因区域,可能对安全的转基因插入更有效。
遗憾的是,在人类基因组中,并不存在逆转录转座子R2,但是,人类基因组中保留了保守的R2插入位点。因此,研究团队从超过20种动物的基因组中筛选了不同种属的R2,从昆虫到鲎再到鸟类,最终在斑胸草雀和白喉麻雀中找到了一种高度特异性靶向人类基因组rDNA区域的逆转录转座子R2,并能有效地将长片段DNA插入该区域。

白喉麻雀(左)和斑胸草雀(右)
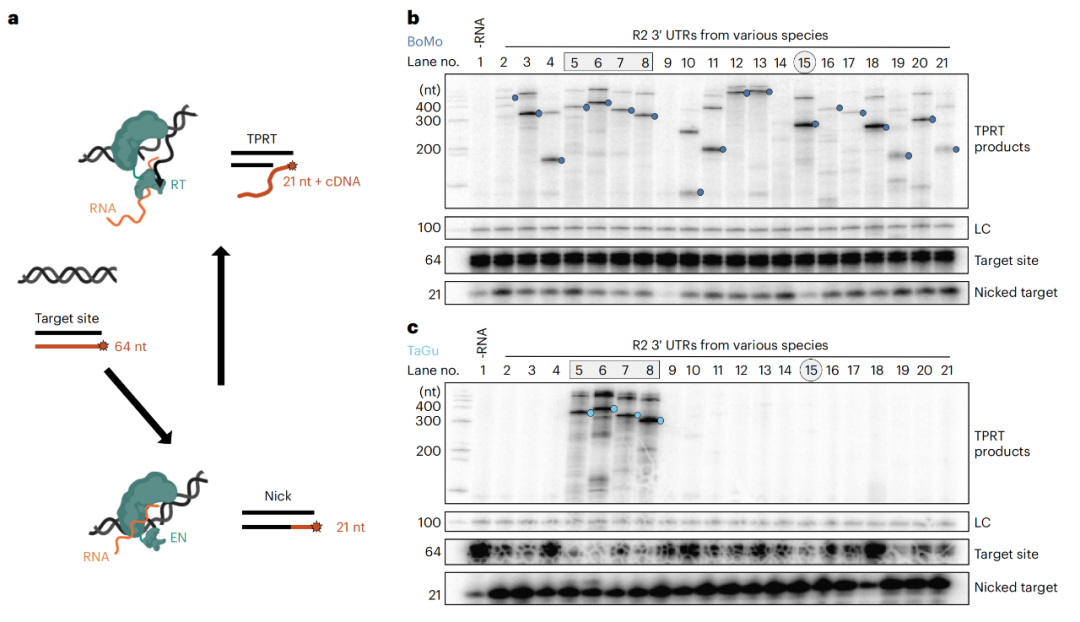
鸟类R2蛋白的生化活性和特异性
在上述发现的基础上,研究团队开发了PRINT技术,其包含一段编码R2蛋白的mRNA,一段编码插入基因的模板RNA,以及R2蛋白插入基因组的基因表达调控元件。通过共转染将其导入到培养的人类细胞中,R2成功地将绿色荧光蛋白(GFP)基因插入到人类细胞的基因组中。
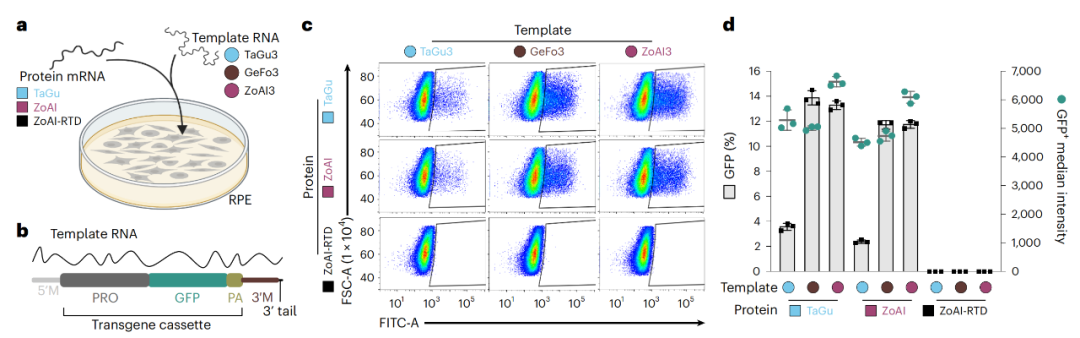
PRINT技术可以将转基因插入到人类细胞的基因组中,并成功表达
进一步的研究表明,转基因确实插入到基因组的rDNA区域,大约每10个RNA模板拷贝可以完成1次插入,并且不会破坏rDNA基因的正常功能。
rDNA区域——基因组的“安全港”
逆转录转座子R2的一个关键优势是,它将基因插入到基因组中重复的rDNA区域。该区域包含数百个相同的基因拷贝,每个拷贝都编码核糖体RNA,这种RNA是蛋白质翻译机器——核糖体的重要组成部分。因此,在有如此多的冗余拷贝的情况下,即使转基因插入破坏了其中一个或几个核糖体RNA基因,其他rDNA基因仍足以维持正常功能。
简而言之,rDNA区域就像是基因组中的“安全港”,给予外来船只(转基因)一个安全的避风港,它固若金汤,即使这些船只可能带着“炸药”(引发基因突变),也不会对其造成严重后果。相比之下,基因组的其他小型港口就没有这么坚固,外来船只的冒然进入可能会使其停工停摆(扰乱基因调节或功能),甚至产生永久性破坏(基因失效/诱发癌症)。
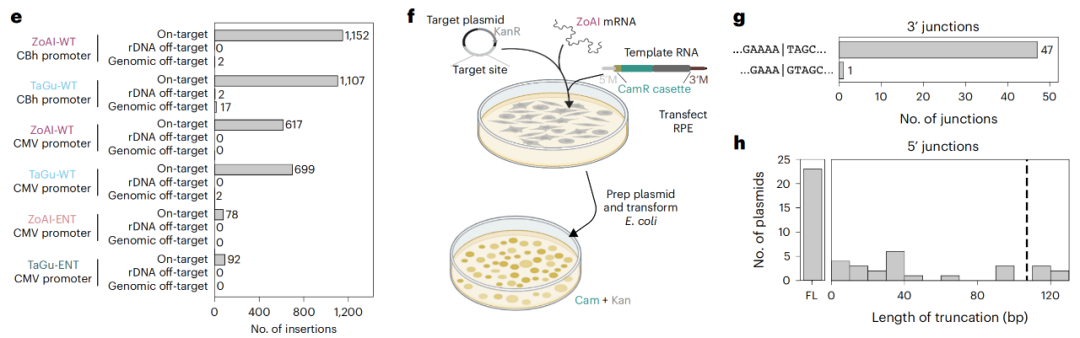
R2介导的转基因插入具有靶向rDNA区域的位点特异性
核仁是一个巨大的核糖体生物发生中心,同时也是一个非常优越的DNA修复环境。在核仁内,rDNA转录受到高度调控,任何插入基因组rDNA区域的转基因都会在核仁内受到小心翼翼的对待,这使得基因插入的致癌风险很低。此外,rDNA区域的众多拷贝也使得它成为一个安全的避风港,你可以破坏其中一两个拷贝,而细胞不在乎,因此该区域成为人类基因治疗植入基因的理想场所。
因此,PRINT技术具有其独特的优势:基于CRISPR-Cas的基因疗法可以修复突变的核苷酸或插入一小块正确DNA序列,就像衣服破了打补丁一样;相比之下,PRINT技术并不修补发生突变的基因,而是在一个新的地方(rDNA区域)增添一个正确的、自主表达的基因拷贝,产生具有正常功能的活性蛋白,就像鞋子坏了再换一双。在某些遗传病背景下,例如同一个基因的不同位点突变导致的遗传病(例如杜氏肌营养不良),PRINT技术可以一次性治疗各种不同突变,其适用性更强。
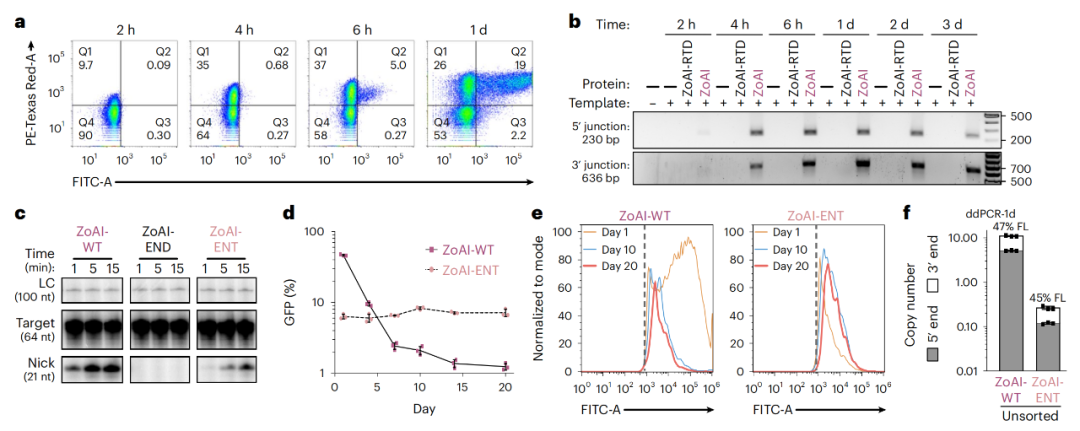
R2介导的转基因的插入效率和表达稳定性
当然,目前关于R2如何工作还有很多未知之处,以及关于rDNA转录的生物学问题仍然存在。例如,rDNA区域承受破坏的极限?一些细胞的rDNA区域的转录活性不活跃,它们是否更容易受到PRINT技术的副作用?
为了回答这些问题,Kathleen Collins 及其团队正在开展进一步研究,同时也在调整与逆转录因子插入有关的各种蛋白质和RNA,以使PRINT技术在培养细胞和来自人体组织的原代细胞中更好地发挥作用。Kathleen Collins 表示,至少目前证明PRINT技术是有效的,但是为了真正实现对它的应用,必须对rDNA区域的生物学过程有更多的了解。

Kathleen Collins
据悉,Kathleen Collins 已经为PRINT技术申请了专利,并参与创立了一家名为 Addition Therapeutics 的公司,以进一步开发基于PRINT技术基因疗法。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


