大坪医院/郑大一附院团队证实,肝脏可清除血液Aβ、降低大脑Aβ负担、抑制AD进展
来源:奇点糕 2023-04-11 16:53
王延江、王俊和许予明领衔的这个研究证实,肝脏清除Aβ能力下降,会增加APP/PS1小鼠大脑Aβ沉积,加重tau磷酸化、神经炎症、神经变性和认知缺陷。
阿尔茨海默病(AD)的治疗,又取得一项重要突破!
近日,由陆军军医大学大坪医院王延江/王俊,以及郑州大学第一附属医院许予明领衔的联合研究团队,在神经科学领域顶级期刊Acta Neuropathologica(《神经病理学报》)发表重磅研究成果[1],证实肝脏在AD毒蛋白Aβ的清除中发挥了重要作用。
具体来说,血液每经过肝脏一次,就有13.9%的Aβ42和8.9%的Aβ40被清除,而且这种清除作用随肝细胞Aβ受体LRP-1因年龄增加的下调而降低。
更重要的是,降低肝脏清除Aβ的能力,会加重AD小鼠模型脑部Aβ负担和认知障碍,而增强肝脏清除Aβ清的能力,可减轻AD小鼠模型脑部Aβ沉积和认知障碍。
也就是说,这个研究直接证实了肝脏有清除外周Aβ,并降低大脑Aβ负担和AD病理进展的能力,意味着提升肝脏清除Aβ的能力,是治疗AD的新方法。

论文首页截图
众所周知,Aβ在大脑中的沉积是AD发病的重要病理特征之一。
Aβ的清除障碍被认为是散发性AD的主要病因,而促进大脑Aβ清除的aducanumab[2]和lecanemab[3]因对早期AD患者表现出有益的疗效,已经获得FDA的批准,成为AD的疾病修正疗法。这意味着,清除Aβ确实是治疗AD的有效手段。
不过,清除大脑Aβ并不只限于用药物直接靶向大脑,外周也是人体清除Aβ的重要途径。由于大脑与外周连通,大约40-60%的脑源性Aβ会通过血脑屏障、淋巴途径等转运到外周,进而被清除[4,5]。只不过,脑源性Aβ究竟在外周的哪个地方清除,又是如何被清除的,目前仍然不清楚。
王延江等将肝脏作为他们的研究对象,因为肝脏是清除血液中代谢物的最大器官,而且肝功能障碍与人类的认知能力下降和AD有关[6,7]。
他们首先基于APP/PS1小鼠模型证实,肝脏可以吸收并清除血液中的Aβ。然后基于兔模型,评估了肝脏清除Aβ的能力,结果发现,从肝脏流出的血液中Aβ42和Aβ40水平分别比流入的血液低13.9%和8.9%。
不难看出,肝确实具备清除Aβ的生理功能。
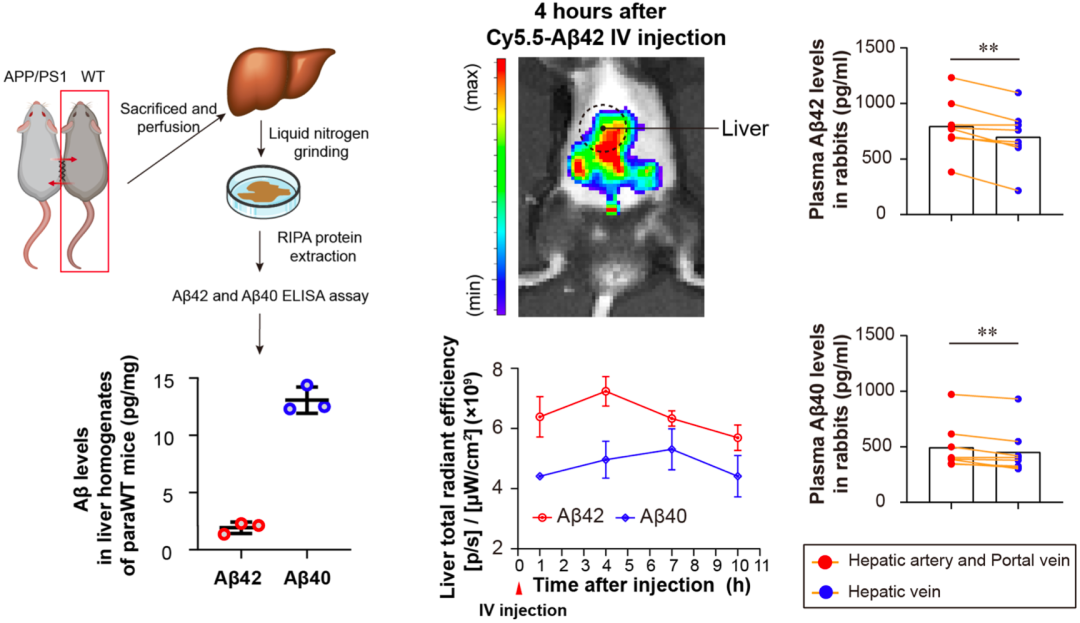
肝脏可以清除血液中的Aβ
他们还基于人体数据发现,与肝功能正常的对照组相比,肝硬化患者血浆Aβ40和Aβ42水平增加。
而部分阻断血液流入AD小鼠模型的肝脏6小时后,就会导致血液中的Aβ42和Aβ40水平分别增加7.1倍和2.9倍,以及大脑间质中的Aβ42和Aβ40水平也分别同步提高了1.5倍和1.2倍。
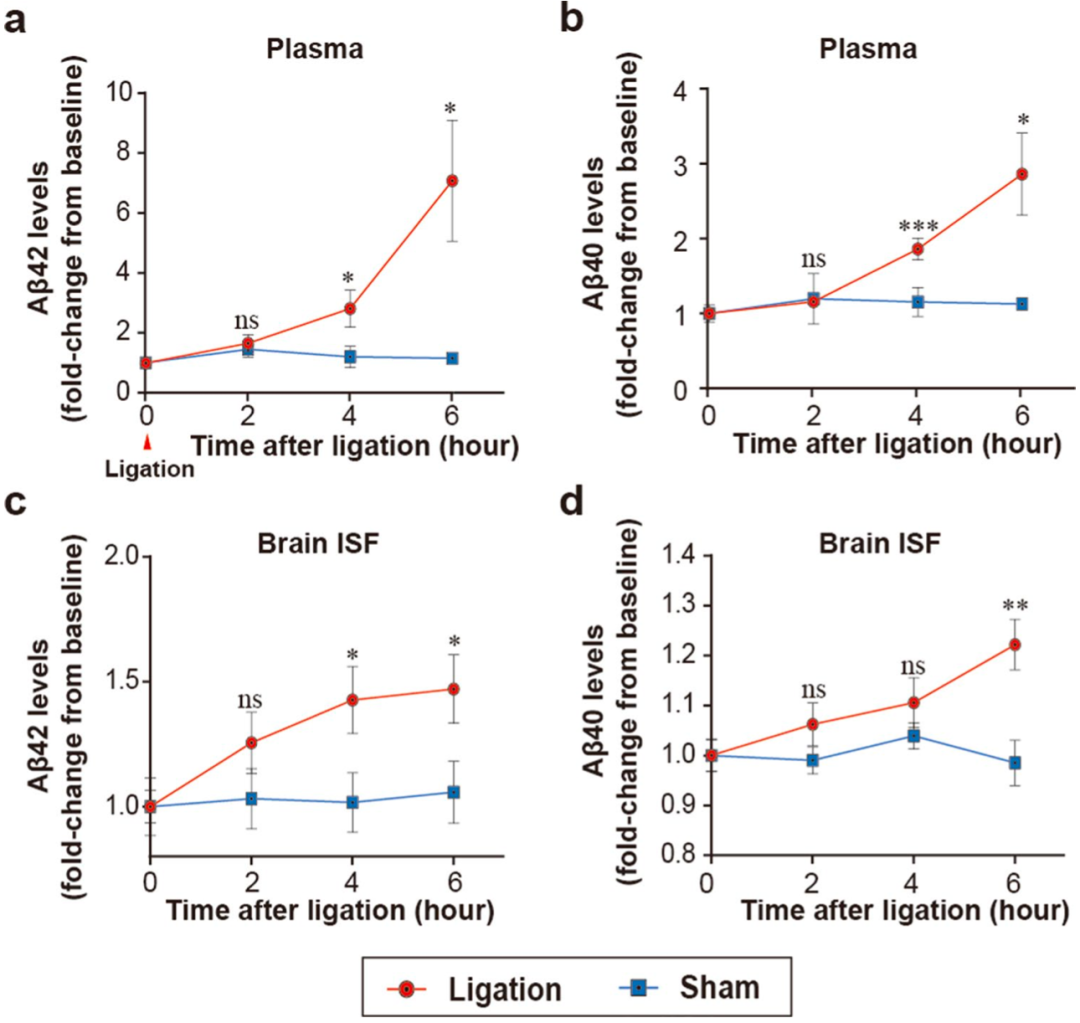
部分阻断对血液和脑间质Aβ的影响
遗憾的是,他们发现肝脏清除Aβ的能力随年龄增长而下降,而且这种下降是肝细胞LRP-1表达的减少所致。这能很好地解释两个现象:第一,即使是认知正常的人,血浆Aβ42和Aβ40水平也会随着年龄的增长而增加;第二,阿尔茨海默病是一种老年病。
需要指出的是,他们发现肝功能指标与年龄和血浆Aβ水平无关。这也意味着,常规肝功能检查不能判断肝脏清除Aβ能力的变化。
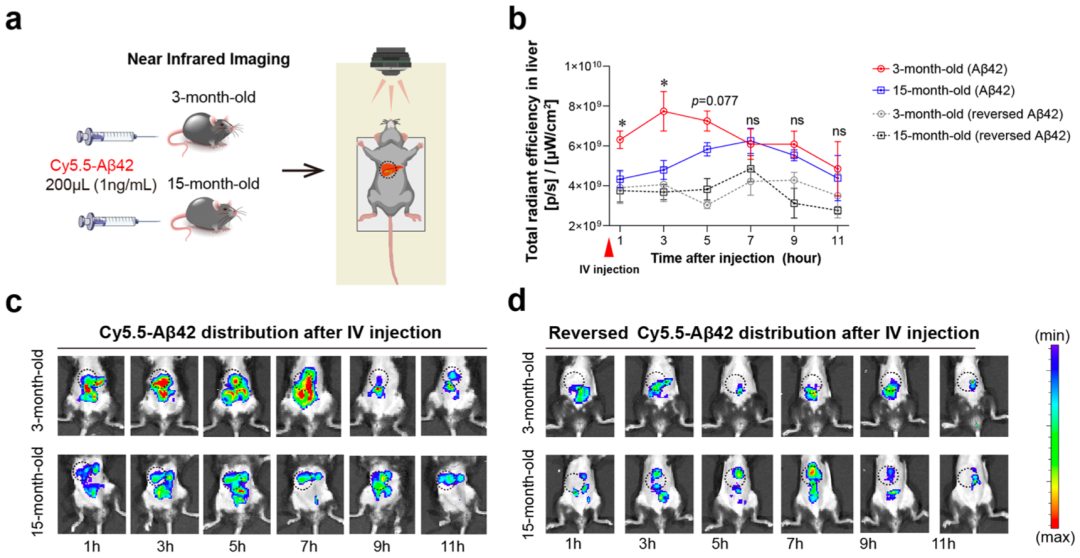
年龄对肝脏清除Aβ的影响
在研究的最后,他们通过特异性在肝脏敲除/过表达LRP-1的方法,探索肝脏清除Aβ的能力对AD病理级小鼠认知的影响。
咱们先来看看特异性敲除肝脏LRP-1的影响。
从Aβ的变化来看:肝脏LRP-1被特异性敲除的AD小鼠模型(AD-AAVshLRP-1)肝脏Aβ水平较低,血液Aβ水平较高;大脑中的Aβ水平也更高,且有更多的Aβ斑块,大脑皮层的Aβ斑块增加了约37%,海马区增加了约43%。
从AD相关病理特征来看:敲除小鼠tau蛋白Thr231磷酸化水平更高,神经炎症加重,轴突变性、神经元凋亡和损伤,以及大脑中树突棘和突触的丧失加剧。
从AD相关的行为表型来看:敲除小鼠的空间学习能力较差,记忆巩固能力较差,空间识别记忆也较差。
一句话,肝脏清除Aβ的能力下降,会导提高脑Aβ负担,加速AD相关病理进展,加重AD相关认知障碍。
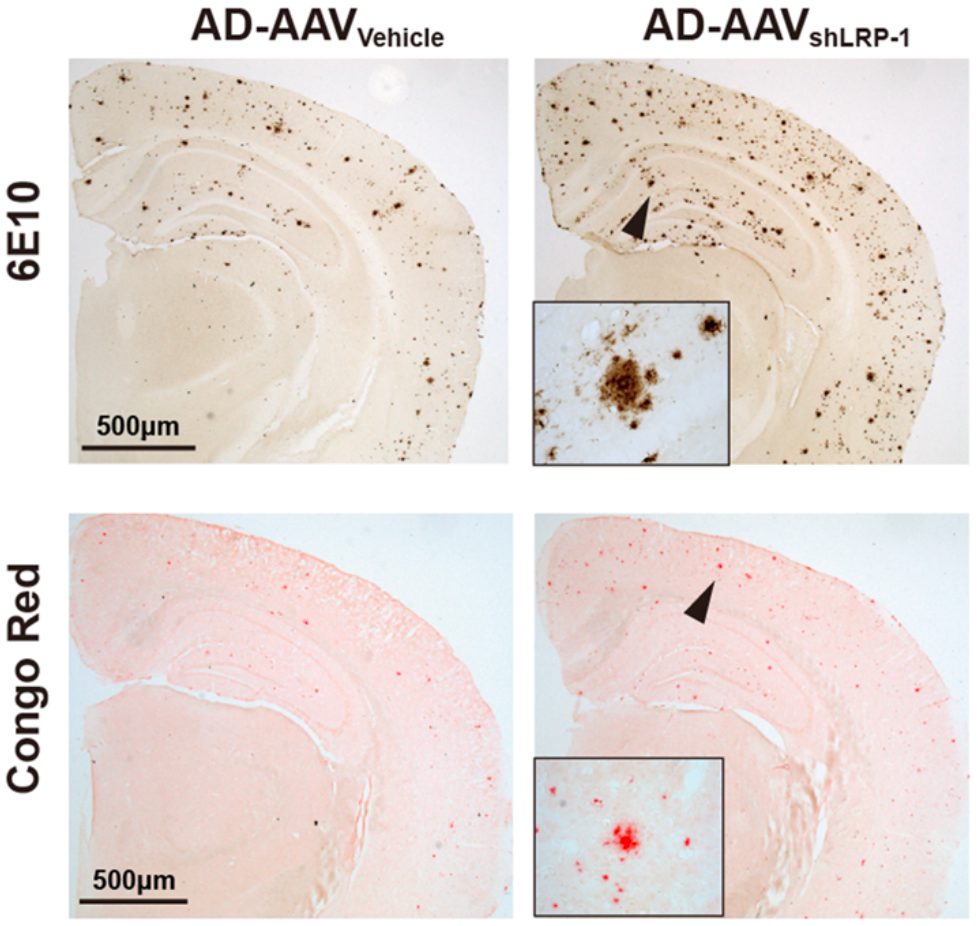
削弱肝脏清除Aβ的能力对脑Aβ负担的影响
如果是在AD小鼠模型肝脏中过表达LRP-1(AD-AAVmLRP-1)的话,就会有与上述结果截然相反的发现。
例如,与LRP-1正常表达的小鼠相比,过表达鼠肝脏Aβ水平高,血液Aβ水平低,大脑中的Aβ水平较低、Aβ斑块较少;tau磷酸化、神经炎症和神经变性的水平较低;并表现出更好的空间学习、记忆巩固和空间识别记忆能力。
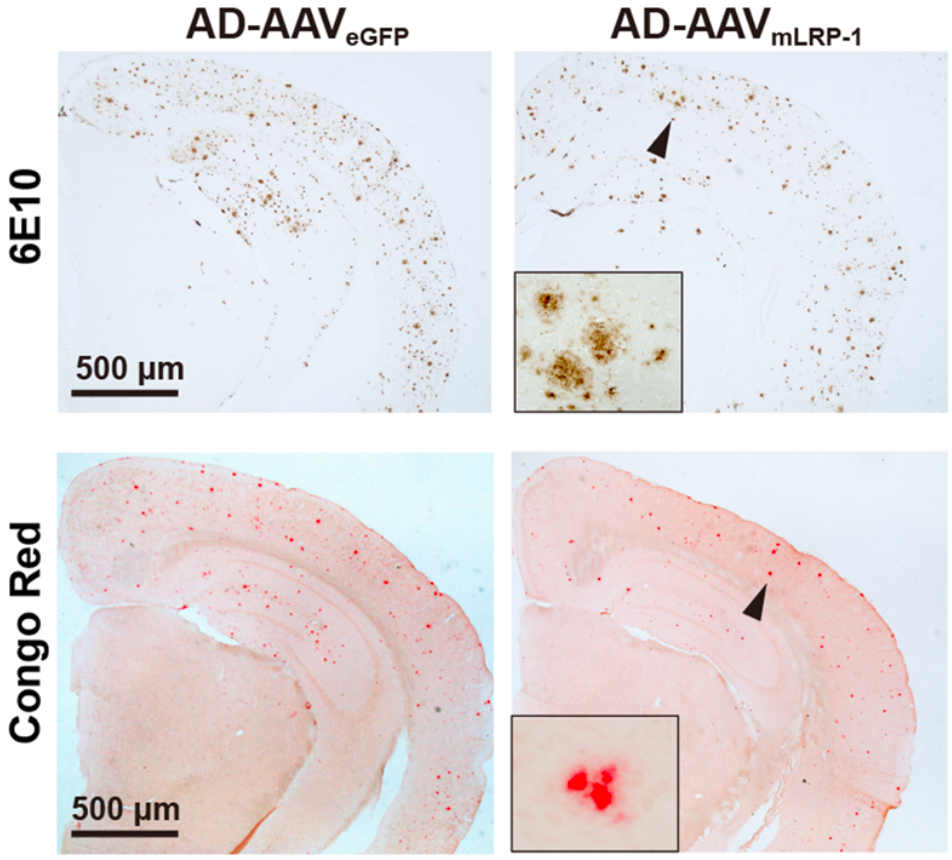
增强肝脏清除Aβ的能力对脑Aβ负担的影响
总的来说,王延江、王俊和许予明领衔的这个研究证实,肝脏清除Aβ能力下降,会增加APP/PS1小鼠大脑Aβ沉积,加重tau磷酸化、神经炎症、神经变性和认知缺陷。
这些发现意味着,肝脏清除Aβ能力的降低是AD发展的帮凶,提升肝脏清除Aβ的能力,或是治疗AD的新方法。另外,由于靶向肝脏的药物无需穿越血脑屏障,因此或可避免药物对大脑的不利影响。
参考文献:
[1].Cheng Y, He CY, Tian DY, et al. Physiological β-amyloid clearance by the liver and its therapeutic potential for Alzheimer's disease Acta Neuropathol. 2023. doi:10.1007/s00401-023-02559-z
[2].Budd Haeberlein S, Aisen PS, Barkhof F, et al. Two Randomized Phase 3 Studies of Aducanumab in Early Alzheimer's Disease. J Prev Alzheimers Dis. 2022;9(2):197-210. doi:10.14283/jpad.2022.30
[3].van Dyck CH, Swanson CJ, Aisen P, et al. Lecanemab in Early Alzheimer's Disease. N Engl J Med. 2023;388(1):9-21. doi:10.1056/NEJMoa2212948
[4].Qosa H, Abuasal BS, Romero IA, et al. Differences in amyloid-β clearance across mouse and human blood-brain barrier models: kinetic analysis and mechanistic modeling. Neuropharmacology. 2014;79:668-678. doi:10.1016/j.neuropharm.2014.01.023
[5].Xiang Y, Bu XL, Liu YH, et al. Physiological amyloid-beta clearance in the periphery and its therapeutic potential for Alzheimer's disease. Acta Neuropathol. 2015;130(4):487-499. doi:10.1007/s00401-015-1477-1
[6].Newton JL, Hollingsworth KG, Taylor R, et al. Cognitive impairment in primary biliary cirrhosis: symptom impact and potential etiology. Hepatology. 2008;48(2):541-549. doi:10.1002/hep.22371
[7].Nho K, Kueider-Paisley A, Ahmad S, et al. Association of Altered Liver Enzymes With Alzheimer Disease Diagnosis, Cognition, Neuroimaging Measures, and Cerebrospinal Fluid Biomarkers. JAMA Netw Open. 2019;2(7):e197978. doi:10.1001/jamanetworkopen.2019.7978
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


