Cancer Cell丨毛开睿团队空间解析肿瘤抑制性免疫微环境
来源:生物探索 2024-07-20 13:34
这项研究揭示了肿瘤抑制性免疫微环境的空间组织结构、驱动其形成的分子机制及其相应的生理功能。
肿瘤微环境(TME)由增殖的恶性肿瘤细胞、异质性的免疫细胞、多种成纤维细胞以及血管淋巴管内皮细胞和细胞外基质元素组成【1】。这些不同的成分通过直接细胞接触以及旁分泌或自分泌通讯在肿瘤内动态建立各种微结构。微环境中免疫细胞的组成、空间结构和功能状态对肿瘤免疫逃逸和进展以及对免疫治疗的响应性产生重大影响。尽管单细胞 RNA 测序等技术已经为我们描绘了TME 中的免疫和非免疫细胞的组成和功能状态【2-4】,但是这些细胞的空间分布特征、细胞间的交互作用及其对细胞状态的维持和抗肿瘤或促肿瘤功能的作用尚不清楚。
调节性 T 细胞 (Treg) 是一种抑制性T细胞亚群,特异性表达转录因子Foxp3,在调节免疫稳态和抑制自身免疫反应中发挥不可替代的作用,同时,它们在 TME 中的富集也会抑制抗肿瘤免疫应答。Treg 可以利用多种方式来抑制自身免疫反应和抗肿瘤免疫应答。这些抑制作用可以是细胞接触依赖性的,如 Treg可以通过CTLA-4 与树突状细胞 (DC) 上的共刺激分子CD80和CD86结合并通过胞啃作用下调其表达,通过LAG3与MHC-II 分子的结合抑制树突状细胞抗原递呈,也可以通过颗粒酶和穿孔素对靶细胞进行裂解。与此同时,Treg也能够通过非细胞接触依赖方式发挥抑制作用,如分泌IL-10、IL-35和TGF-β等抑制性细胞因子,通过CD25与T细胞竞争微环境中的IL-2,亦或者通过表达CD39和CD73将细胞外ATP转化为腺苷,从而抑制效应T细胞的活化【5, 6】。尽管已有许多研究表明肿瘤微环境中Treg细胞在肿瘤逃逸机体免疫反应中具有十分重要的作用,然而Treg细胞在肠道肿瘤微环境中的分布特征、状态维持以及功能作用机制并不清楚。
2024年7月18日,细胞应激生物学国家重点实验室、厦门大学生命科学学院/翔安医院毛开睿团队在Cancer Cell杂志上在线发表了题为Lymphatic-localized Treg-mregDC crosstalk limits antigen trafficking and restrains anti-tumor immunity的研究论文,揭示了肿瘤微环境中Treg独特的空间定位及其抑制抗肿瘤免疫反应的新机制。

肿瘤基质部位形成Treg-mregDC-淋巴管生态位
利用多重免疫荧光技术和小鼠自发性肠道肿瘤模型(ApcMin/+小鼠),研究人员对肿瘤微环境中的主要免疫细胞亚群进行染色,发现大量的 Foxp3+ Treg细胞特异性地聚集在肿瘤边缘的基质部淋巴管周围(图1)。对肿瘤中免疫细胞进行单细胞RNA测序(scRNAseq)分析,发现肿瘤中一部分Treg细胞呈现活化状态,并且与调节性成熟树突状细胞(mature dendritic cells enriched in immunoregulatory molecules, mregDCs)存在紧密关联。免疫荧光染色进一步验证了Treg与mregDC共同聚集在淋巴管周围,并且将此空间分布特征命名为Treg-mregDC-淋巴管生态位(图2)。
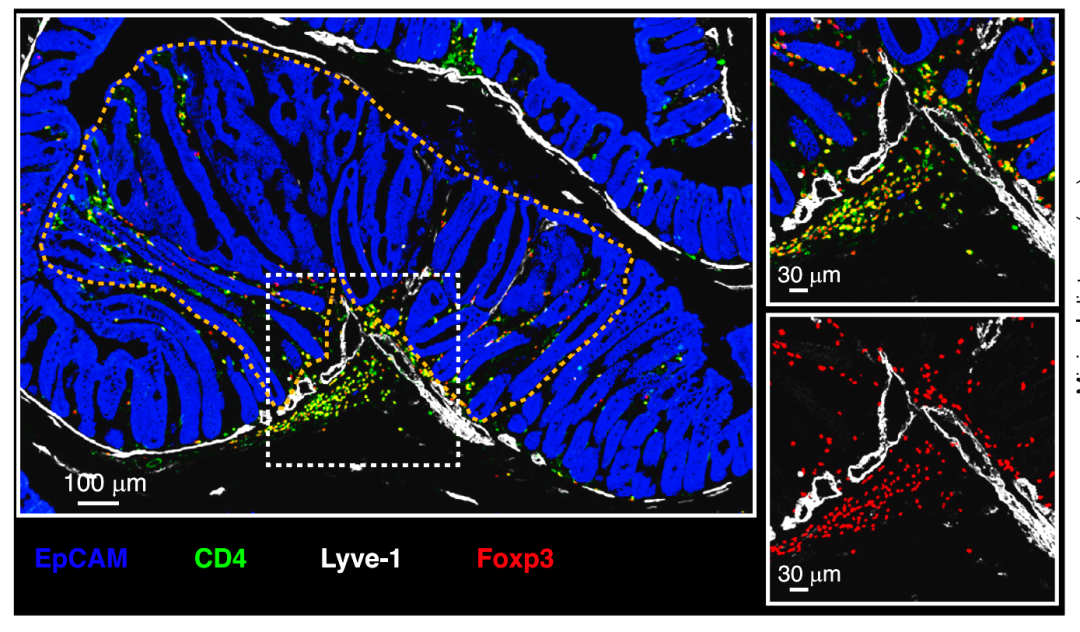
图1 Treg特异性聚集在肿瘤基质部淋巴管周围(Credit: Cancer Cell)
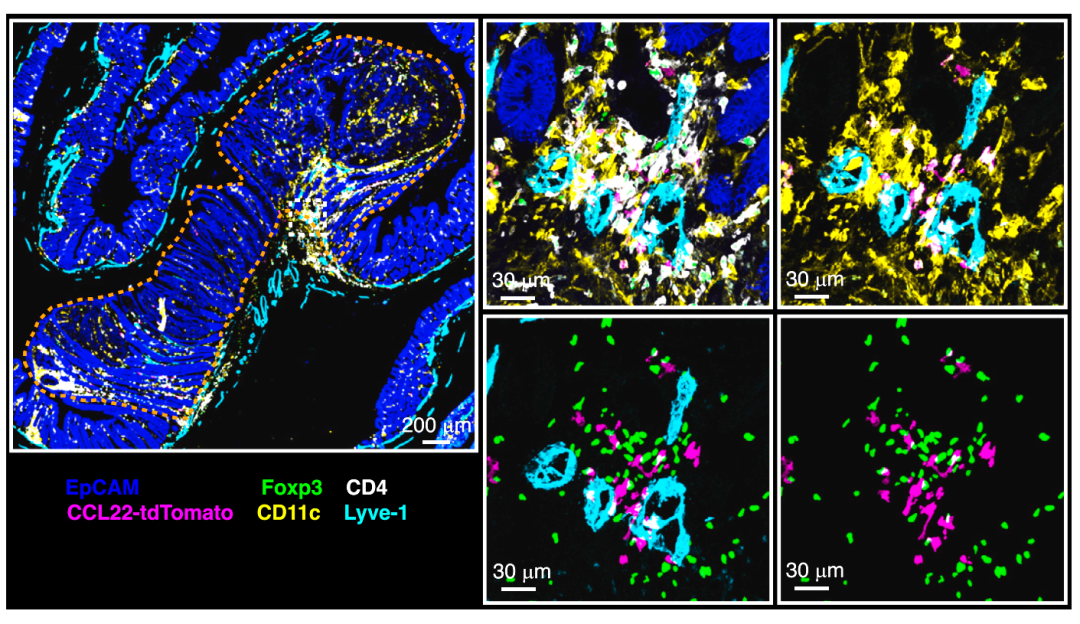
图2 肿瘤基质部形成Treg-mregDC-淋巴管生态位(Credit: Cancer Cell)
Treg-mregDC-淋巴管生态位维持Treg细胞活化表型
scRNAseq数据揭示了 TME 中 Treg细胞活化状态存在异质性,其中一部分细胞呈现活化特征,而另一部分则维持静息状态。为了研究Treg活化表型与其空间分布特征之间的关联,研究人员使用PD-1 和 OX-40 以及 Foxp3来表征活化Treg,利用多重定量免疫荧光技术,揭示了 PD-1high 和 OX-40 high Treg在空间上与mregDC的紧密关系(图3)。同时,Nur77报告基因小鼠也表明Treg与mregDC在淋巴管周围的相互作用支撑了Treg在肿瘤微环境的局部活化。当利用MHC-II抗体阻断Treg与mregDC的相互作用后,Treg细胞表面活化相关分子(PD-1、CTLA-4、TIM-3、OX-40 和 ICOS)的表达水平下降。这些证据表明Treg 和 mregDC之间的互作促进并维持肿瘤微环境中Tregs的活化状态,从而增强其免疫抑制功能。
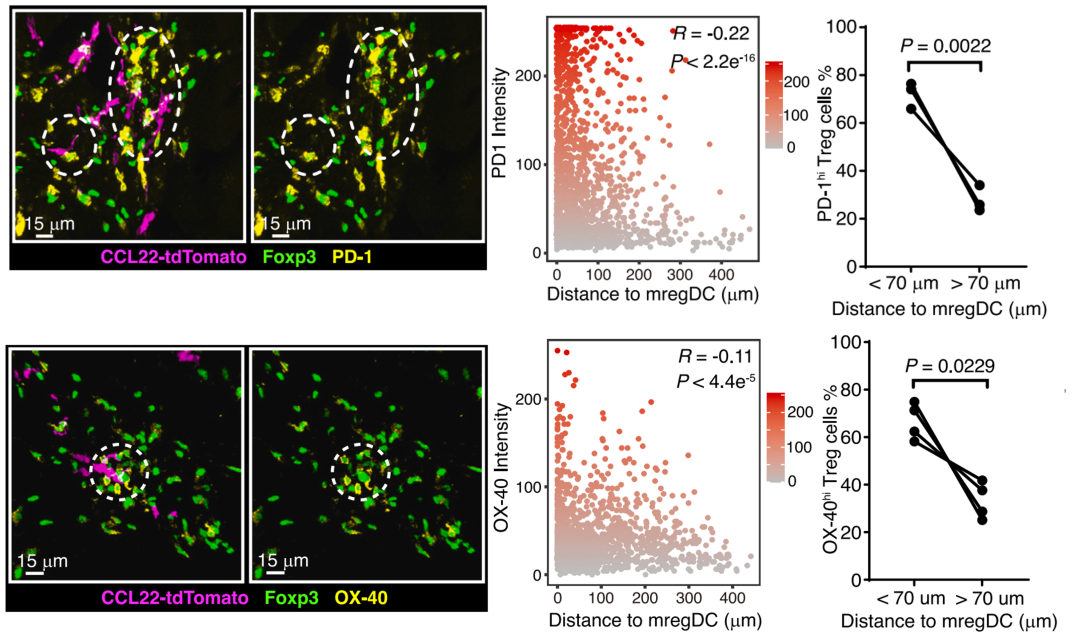
图3 mregDC促进并维持Treg细胞的活化表型(Credit: Cancer Cell)
阻断Treg-mregDC-淋巴管生态位的形成抑制肿瘤进展
Treg 和 mregDC 除了通过细胞膜表面分子直接接触外,mregDC还有可能通过分泌趋化因子CCL22/17将Treg招募到其周围。为了验证该趋化作用在Treg-mregDC-淋巴管生态位形成中的作用,研究人员将Ccl22tdTomato 和 Ccr4-/- Ubi-GFP 骨髓细胞移植到辐照后的 ApcMin/+小鼠中,构建了混合骨髓嵌合小鼠,发现CCR4缺失的Treg细胞无法准确定位到mregDC周围,因而也无法获得活化的表型特征。进一步,研究人员构建了 ApcMin/+背景下Treg 特异性 CCR4 缺陷小鼠(ApcMin/+ Foxp3Cre Ccr4fl/fl),当Treg 缺失CCR4后,小鼠肿瘤的生长也受到明显的抑制。这些结果表明 CCR4 介导了 Treg 迁移到mregDC周围,并通过与其相互作用获得活化表型,增强其免疫抑制功能,促进肿瘤免疫逃避。
Treg 抑制mregDC将肿瘤抗原携带到引流淋巴结,从而限制抗肿瘤免疫反应的起始
接下来,研究人员进一步探讨Treg如何在Treg-mregDC-淋巴管生态位中发挥抑制抗肿瘤免疫应答的功能。由于mregDC具备成熟活化和迁移特征(高表达CD80、 CD86和CCR7),其主要功能是携带肿瘤抗原迁移到引流淋巴结起始抗肿瘤免疫应答。因此研究人员通过在肿瘤原位注射荧光标记的卵清蛋白 (FITC-OVA) 以模拟肿瘤抗原,发现引流淋巴结中携带FITC-OVA的迁移性DC数量明显减少。当特异性清除Treg或阻断Treg与mregDC相互作用能明显增强肿瘤抗原向引流淋巴结的转运(图4),同时促进识别肿瘤免疫抗原T细胞在引流淋巴结中的增殖。进一步作者还发现清除Treg或阻断Treg与mregDC相互作用后,肿瘤中mregDC上CCR7、CD80和CD86表达水平显著上升,从而增强其携带肿瘤抗原到引流淋巴结的迁移。综上所述,TME中活化的Treg通过与mregDC的相互作用抑制肿瘤抗原到引流淋巴结的转运过程,阻碍抗肿瘤适应性免疫应答的起始,进而促进肿瘤的发生发展。
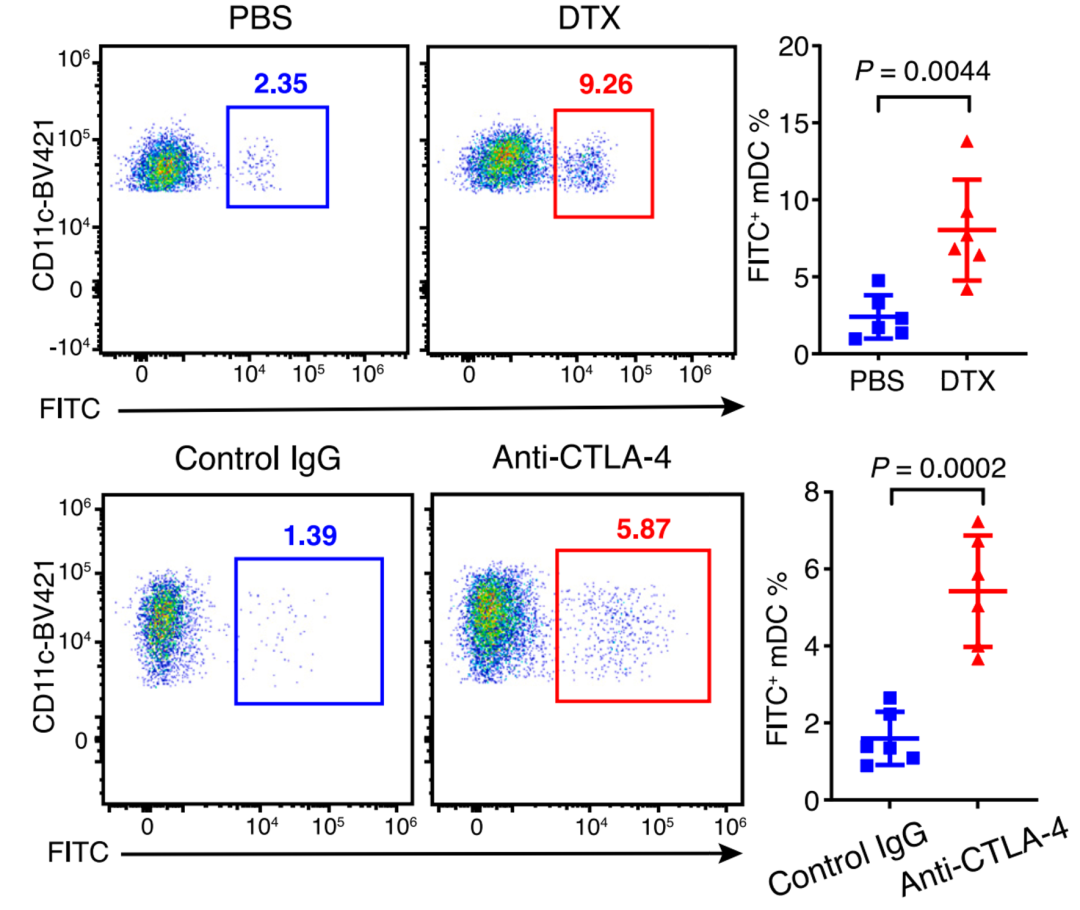
图4 Treg以CTLA-4依赖方式抑制肿瘤抗原到引流淋巴结的转运(Credit: Cancer Cell)
Treg与mregDC的互作也存在于人类结直肠癌中并导致不良预后
为了探究Treg与mregDC的相互作用是否也存在于人类肿瘤中,研究人员对已发表的结直肠癌的空间转录组数据进行深入分析,发现活化Treg和mregDC的特征基因也聚集性地分布在肿瘤基质的淋巴管周围,形成与ApcMin/+ 小鼠同样的 Treg-mregDC-淋巴管生态位。接下来,研究人员进一步评估了Treg和 mregDC之间的这种空间互作对肿瘤预后的影响,通过对TCGA 数据库进行分析,发现活化Treg特征基因表达水平低同时高表达mregDC特征基因(actTreglow mregDChigh)的肿瘤患者具有显著的生存优势。这些结果与小鼠模型中的现象一致,表明Treg 和 mregDC 在肿瘤淋巴管周围的互作构成了阻碍抗肿瘤免疫应答的抑制性免疫微环境,从而降低患者生存率。
总的来说,这项研究揭示了肿瘤抑制性免疫微环境的空间组织结构、驱动其形成的分子机制及其相应的生理功能(图5)。这不仅加深了我们对肿瘤免疫逃逸的理解,还为肿瘤免疫干预提供了新的策略。
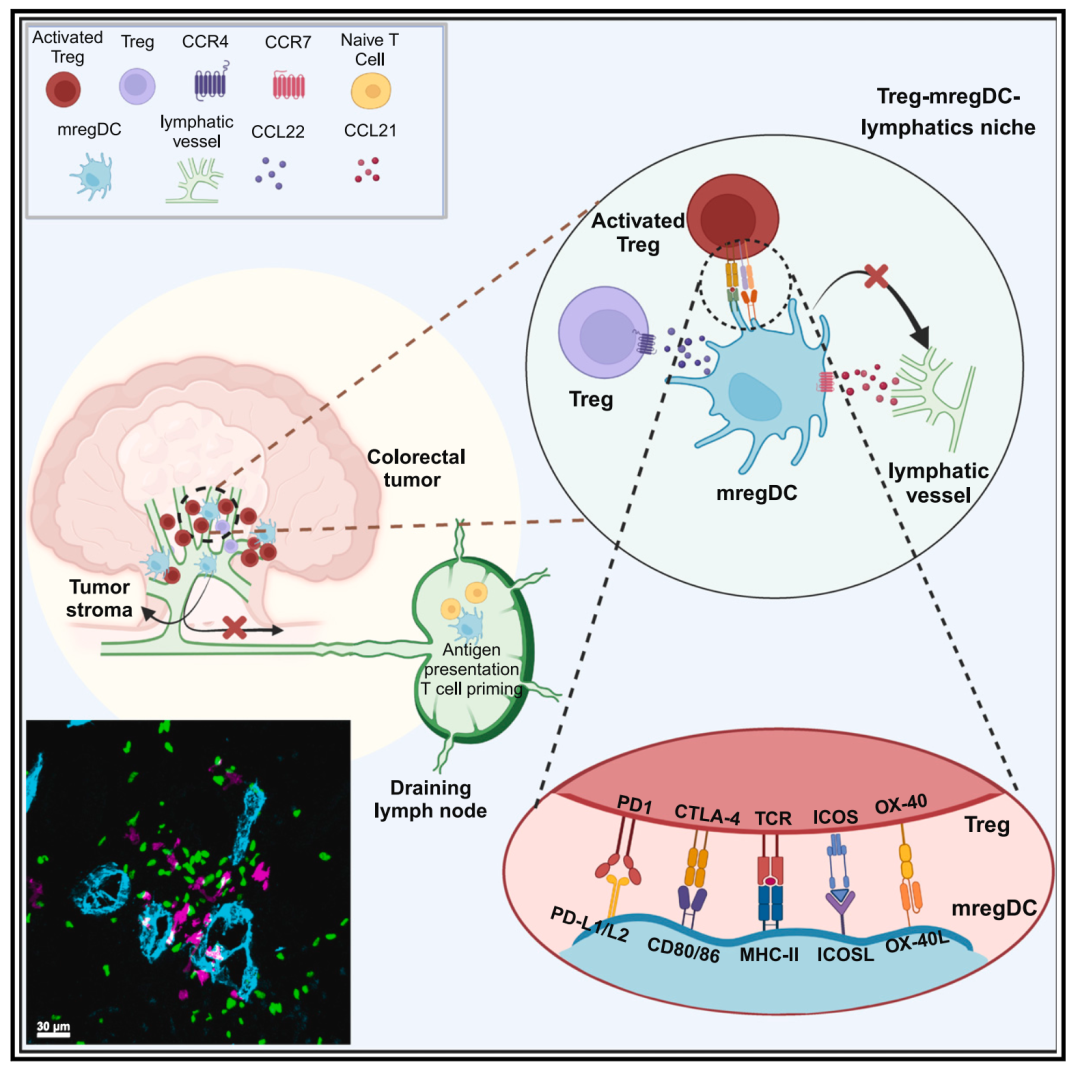
图5 Treg-mregDC-lymphatic生态位抑制抗肿瘤免疫应答(Credit: Cancer Cell)
参考文献
1 Binnewies, M. et al. Understanding the tumor immune microenvironment (TIME) for effective therapy. Nat Med 24, 541-550 (2018). https://doi.org:10.1038/s41591-018-0014-x
2 Ren, X. et al. Insights Gained from Single-Cell Analysis of Immune Cells in the Tumor Microenvironment. Annu Rev Immunol 39, 583-609 (2021). https://doi.org:10.1146/annurev-immunol-110519-071134
3 Jackson, H. W. et al. The single-cell pathology landscape of breast cancer. Nature 578, 615-620 (2020). https://doi.org:10.1038/s41586-019-1876-x
4 Zilionis, R. et al. Single-Cell Transcriptomics of Human and Mouse Lung Cancers Reveals Conserved Myeloid Populations across Individuals and Species. Immunity 50, 1317-1334.e1310 (2019). https://doi.org:10.1016/j.immuni.2019.03.009
5 Dikiy, S. & Rudensky, A. Y. Principles of regulatory T cell function. Immunity 56, 240-255 (2023). https://doi.org:10.1016/j.immuni.2023.01.004
6 Tay, C., Tanaka, A. & Sakaguchi, S. Tumor-infiltrating regulatory T cells as targets of cancer immunotherapy. Cancer Cell 41, 450-465 (2023). https://doi.org:10.1016/j.ccell.2023.02.014
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


