肝细胞源性外体miR-27A通过抑制PINK1介导的线粒体自噬激活MAFLD中的肝星状细胞
来源:本站原创 2021-12-30 10:26
在代谢相关脂肪性肝病(MAFLD)中,外泌体介导的线粒体自噬在肝细胞(HCs)和肝星状细胞(HSCs)之间的串扰中的作用尚不清楚。
在代谢相关脂肪性肝病(MAFLD)中,外泌体介导的线粒体自噬在肝细胞(HCs)和肝星状细胞(HSCs)之间的串扰中的作用尚不清楚。MAFLD患者和小鼠血清外体miR-27A水平明显升高,且与肝纤维化程度呈正相关。外泌体miR-27A从脂毒性HCS中释放出来,并特异性地传递给受体激活的HSCs。PINK1是miR-27A的关键靶点,主要介导线粒体自噬。
图片来源: https://doi.org/10.1016/j.omtn.2021.10.022.
所有常驻肝细胞群之间的细胞相互作用在肝病的发生和发展中是重要的,而外泌体在细胞间转导中起着至关重要的作用。外泌体miRNAs具有特别重要的表观遗传功能,能够在转录后调节基因表达。在HCS中,由于脂质的积累,外切体含量增加并发生变化。探索关键的外体miRNAs对于理解MAFLD相关的纤维化具有重要意义。作者发现MAFLDALF患者和HFD喂养的肝硬化小鼠血清外体miR-27A水平显著升高。
此外,脂毒性hc释放额外的携带大量miR27a的外泌体,这些外泌体是体外miR27a的主要来源。因此,作者首次证明血清外膜miR-27A水平与肝纤维化程度呈正相关,可用于有效鉴别MAFLD患者的ALF。最近的研究结果表明,HC外泌体是调节HSC增殖和分化的重要因素。
在本研究中,通过模拟HSC和HSCs近端通讯的体外原代细胞培养实验,证实脂毒性HC外切体被激活的HSCs优先和迅速地摄取。然后,作者创新性地假设脂毒性HC外泌体携带并特异性地将大量miR27a传递给受体激活的造血干细胞。
已有研究报道,miR-27a在肝硬化患者和大鼠体内过表达,miR27a可促进MAFLD小鼠HSCs增殖和活化,诱导甘油三酯蓄积。在帕金森氏病中,miR-27A首次被证明通过靶向PINK1(最重要的有丝分裂调节因子)来调节线粒体自噬。因此,作者将重点放在miR-27A和PINK1介导的线粒体自噬之间的关系上,这在MAFLD相关的肝纤维化中尚未被探索。线粒体自噬是清除受损线粒体以维持内稳态的有效手段。
为了进一步证实脂毒性HC外泌体的新机制,作者首次报道了脂毒性HC-exosomal miR27a可以通过负靶向PINK1诱导的体内外丝裂原吞噬而发挥相同的促进受体HSC激活的能力。无论在体内外,抑制miR-27A的HCS来源的外切体都不能负向靶向PINK1诱导的有丝分裂吞噬,也不能加重MAFLD相关的肝纤维化。
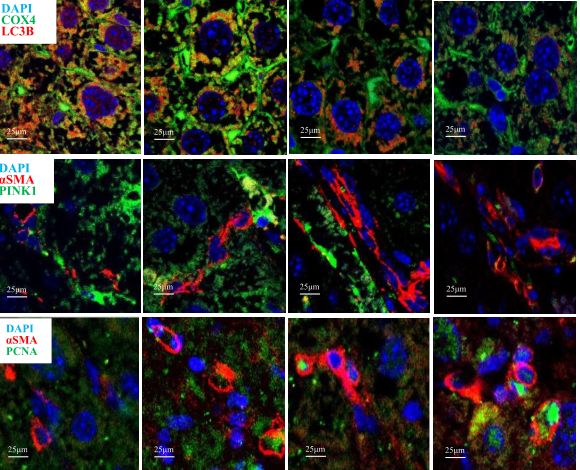
血清miR27a上调抑制PINK1诱导的小鼠肝有丝分裂并加重肝纤维化
图片来源: https://doi.org/10.1016/j.omtn.2021.10.022
综上所述,作者的研究表明脂毒性HC衍生的外泌体优先被激活的HSC摄取。外体miR27a负性调节肝脏PINK1介导的线粒体自噬,促进HSC活化和增殖,加速肝纤维化。这些结果提示,抑制HC-exosomal miR-27A的表达可作为MAFLD相关性肝纤维化的潜在诊断指标和治疗靶点。(生物谷 Bioon.com)
参考文献
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。



