《癌细胞》:棘手的肺鳞癌,到底该怎么治?看纽约大学的专家们盘点破局之道!
来源:奇点糕 2022-12-05 09:30
主要是转录因子SOX2的染色质调节因子LSD1和EZH2,其中抑制LSD1能减少致癌潜力、促进细胞分化,而EZH2的升高与鳞状转化、鳞癌发生发展相关,针对这两个靶点的抑制剂目前均已进入临床试验;此外其
“同人不同命”这句话,在癌症治疗中往往会应验,比如同患一种癌症,有的患者“幸运”地能接受靶向、免疫等精准治疗,而另一些患者却就是无法被惠及,着实令人扼腕。
当然大家现在也都知道,同一种癌症还应该被不断细分,才能准确地指导临床诊疗。就拿再熟悉不过的非小细胞肺癌(NSCLC)来说,按组织学类型划分的腺癌和鳞癌,治疗的套路就完全不同:
肺腺癌患者检出EGFR、ALK两大经典驱动基因突变,以及各种罕见突变的比例很高,所以很有机会用上靶向药;而鳞癌就没有这么多可靶向的位点了,加上肿瘤恶性程度偏高,即使现在有了PD-1/L1抑制剂,患者的预后也不算理想。
那么面对棘手的肺鳞癌,治疗的破局之道是什么呢?哪些创新思路和诊疗策略值得期待?近期在《癌细胞》上,纽约大学医学院的专家团队就共同撰文,对这一问题进行了精彩剖析,一起来看[1]!

肺鳞癌的病因和生物学起源
肺鳞癌与肺腺癌在生物学行为上的相似之处,相比身体其它部位的鳞状细胞癌要更多一些,而且不同人种患者的基因组学分析结果也较为相似,这可能说明相似的环境因素,在不同地区都参与了肺鳞癌的发生发展。目前已知的肺鳞癌相关危险因素主要有:吸烟、饮酒、HPV/EBV等病毒感染。
而在基因组学层面,肺鳞癌中的常见突变可以分为以下几组:1)鳞状细胞分化通路表达,如NOTCH、SOX2、TP63;2)细胞周期调节因子缺失,如TP53、RB1、CDKN2A、MYC;3)RAS和PI3K促癌信号通路的基因表达上调;4)表观遗传调节基因异常,如KMT2D、NSD1、KDM6A。
至于肺鳞癌的细胞起源,既往假说一直认为是基底样干细胞(BSCs)在吸烟影响下出现DNA断裂,此后非同源重组连接(NHEJ)途径的修复导致突变负荷增加、进而发生细胞癌变;但近年来研究显示,2型肺泡细胞(AT2)和棒状细胞也可在转录因子SOX2过表达时发生癌变,它们可能是周围型肺鳞癌的起源。
肺鳞癌靶向治疗的过去
肺鳞癌的突变数其实高于许多癌症(基因突变负荷8.1/Mb,泛癌种均值为1.8/Mb),但文章开头也说了,肺鳞癌目前可用的治疗靶点仍然屈指可数,尤其是针对受体酪氨酸激酶(RTKs)治疗的探索,在关键临床研究中一次次失败。
从下面这张图也能看出,肺鳞癌的靶向治疗相比腺癌真叫一个寒酸,治疗整体的客观缓解率更是只有7%[2]。接下来就以两个已经“撞过南墙”的RTK靶点为例,简单总结一下经验和教训好了。
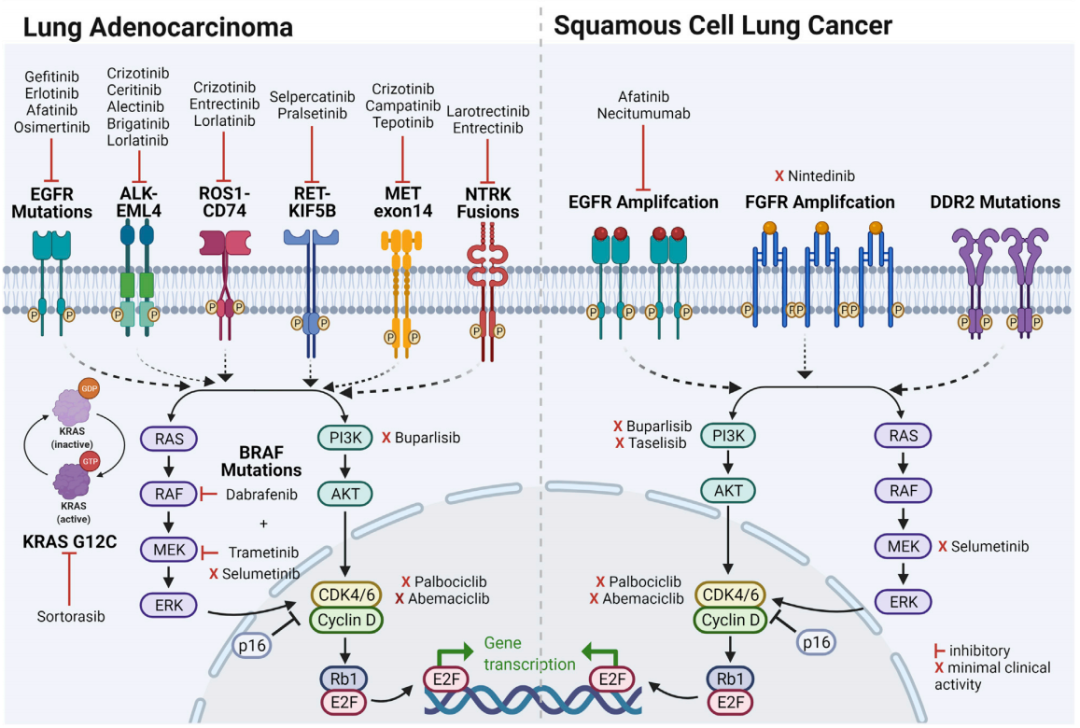
肺腺癌(左)与鳞癌(右)的靶向治疗对比
EGFR
腺癌中大名鼎鼎的EGFR突变,到了鳞癌中被检出时,却往往都不是经典的敏感突变,这就使得酪氨酸激酶抑制剂(TKI)类靶向药的疗效很不理想,患者的无进展生存期(PFS)明显不及腺癌人群,只有阿法替尼获批用于鳞癌治疗,这可能提示对EGFR等治疗靶点的筛选需要继续细化,才能找到可获益的患者。
FGFR
成纤维细胞生长因子受体(FGFR)扩增在肺鳞癌中的发生率约为20%,也被明确与患者不良预后有关,但靶向FGFR-1的TKI尼达尼布没能闯过III期研究。后续的基础研究显示,FGFR扩增可能并不会促癌,靶向它才会无功而返。
靶向信号转导通路
同样是靶向单个位点,肺鳞癌中EGFR、FGFR的靶向治疗失败,跟隔壁肺腺癌的成果不断,对比实在有点鲜明,这可能反映出在肺鳞癌中,单一基因突变较难成为“驱动基因”,多个信号通路相互交织才是常态。那么针对信号转导通路,比如经典的RAS-RAF-MEK通路、PI3K-AKT通路进行阻断,是否会有用呢?
答案目前还是否定的。拿KRAS突变来说,虽然它的靶向治疗近几年开始加速发展,但在鳞癌中1-6%的突变频率,就让进一步探索相当不易;而MEK抑制剂已在III期研究中失利,PI3K抑制剂们甚至没能交出足以开展III期研究的疗效数据,而且这些信号通路容易“牵一发而动全身”,治疗毒性也是不容忽视的问题。
此外,还有临床研究探索了靶向细胞周期相关位点,也就是CDK4/6抑制剂在肺鳞癌中的治疗价值,但6%的缓解率确实不值得继续推进临床研究,不过细胞周期相关蛋白的异常,在肺鳞癌中还是很多见的,理清上下游通路也许会有收获。
肺鳞癌靶向治疗的现在
新时代的靶向治疗已经不再局限于基因组,从表观遗传学、代谢组学的角度入手,同样有希望找到好的靶点。
表观遗传治疗
肺鳞癌整体的DNA甲基化水平较低,但特定位点的高甲基化会沉默抑癌基因,同时表观遗传异常也会增加肿瘤的异质性和可塑性,下图中列出了肺鳞癌表观遗传相关的潜在治疗靶点。
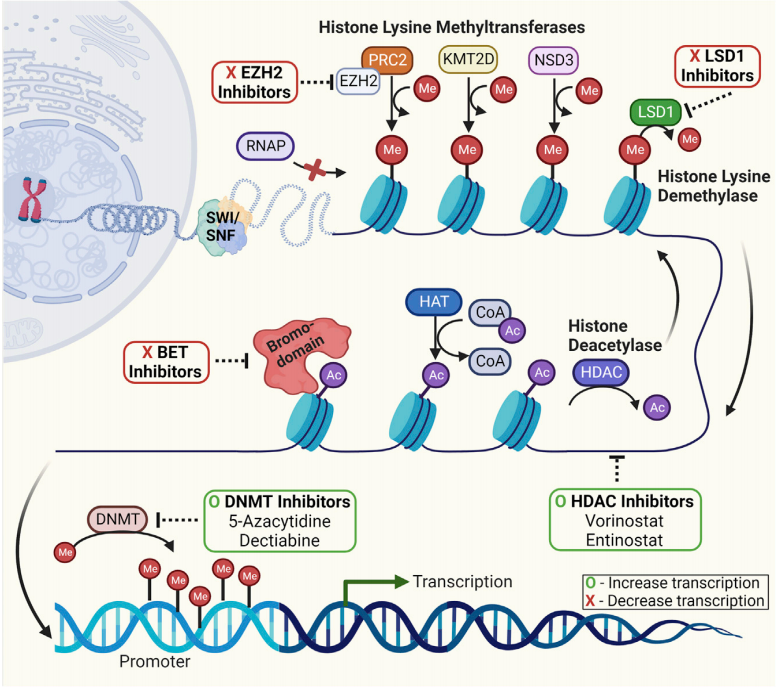
肺鳞癌表观遗传相关的治疗靶点
被综述作者们重点列出的靶点,主要是转录因子SOX2的染色质调节因子LSD1和EZH2,其中抑制LSD1能减少致癌潜力、促进细胞分化,而EZH2的升高与鳞状转化、鳞癌发生发展相关,针对这两个靶点的抑制剂目前均已进入临床试验;此外其它表观遗传的调节因子,如KMT2D、NSD3也可能成为治疗靶点,表观遗传治疗甚至有可能针对经靶向治疗后,由腺癌转化而成的鳞癌患者。
靶向“代谢弱点”
肺鳞癌存在人葡萄糖转运蛋白1(GLUT1)高表达、高度依赖糖酵解等特征,但直接精准靶向葡萄糖代谢的难度很大,因此可以考虑将肺鳞癌患者进一步细分,针对不同患者肿瘤的“代谢弱点”展开治疗。
综述作者们以KEAP1-NRF2通路突变人群为例进行了说明,该通路对氧化应激响应有调控作用,肺鳞癌中较多见的是编码转录因子NRF2的NFE2L2基因发生功能获得性突变,而NRF2信号通路的持续激活则会介导代谢重编程,使癌细胞消耗的谷氨酰胺增多,导致三羧酸循环中出现可以针对的“代谢瓶颈”。
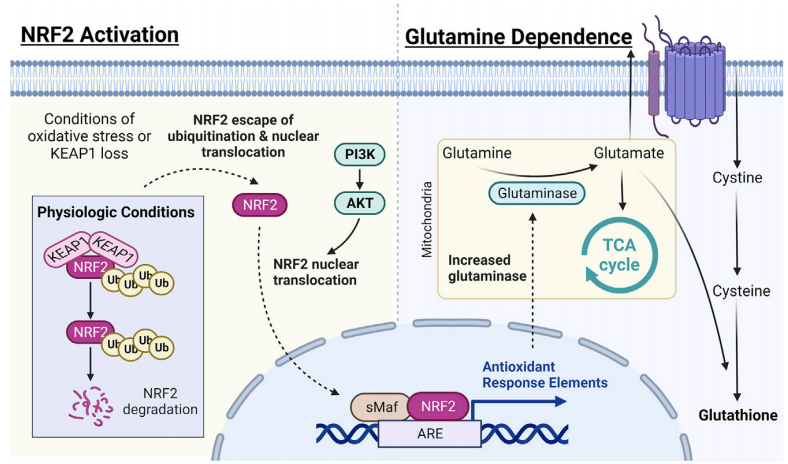
KEAP1-NRF2通路可被靶向的原因
不过由于肺鳞癌较强的异质性,不同患者肿瘤中的代谢状况不尽相同,很难靠一招就实现通吃,所以靶向代谢弱点的治疗,可能需要配合其它手段共同使用,例如近期有研究显示,谷氨酰胺酶抑制剂还可能同时影响CD8+细胞毒性T细胞的抗肿瘤活性[3],所以可能要靠PD-1抑制剂来弥补这方面的影响。
肺鳞癌靶向治疗的未来
寻找预测疗效的生物标志物
可靠的生物标志物对精准治疗极为重要,但肺鳞癌异质性强的特点,决定了未来需要对患者进行更精细的分类,综述作者认为可对全部患者在治疗前进行二代测序(NGS),从而预测肿瘤生物学行为和疗效,提供临床研究入组信息,并尝试开发指导治疗的多基因评分系统,以及提出有临床意义的肺鳞癌亚型分类。
需要生物标志物的不仅有靶向治疗,还有免疫治疗,现有的PD-1/L1抑制剂们用于鳞癌时仍然表现一般,PD-L1、肿瘤突变负荷(TMB)作为标志物也还不够理想,后续可考虑寻找肿瘤微环境中免疫抑制性组分相关的标志物。
开展个体化的联合治疗
在许多单药治疗的临床研究撞得头破血流之后,新型治疗手段应该联手向肺鳞癌出击,尤其是基于PD-1/L1抑制剂的联合治疗方案,但这就需要充分破解肺鳞癌的免疫抑制性微环境,尤其是大量存在、抑制免疫细胞活性的肿瘤相关中性粒细胞(TANs),以及髓系来源的免疫抑制细胞(MDSCs)。
另外还有蛋白组学研究指出,肺鳞癌整体可以分为两种免疫亚型,即炎症型和氧化还原型,前者的基因突变较少,但存在大量髓系细胞浸润;后者则存在NRF2的持续激活,导致免疫浸润较差和明显的代谢重编程,但两种亚型的PD-L1表达并没有明显差异,这可能解释了PD-L1表达水平指导免疫治疗的可靠性欠佳[4]。
而靶向治疗部分提到的多个位点,例如PI3K扩增、KEAP1-NRF2通路激活以及表观遗传改变,可能也都会影响免疫状态和免疫治疗的效果,因此免疫+新型靶向治疗方案将会是接下来临床探索的主流。
结语
虽然肺鳞癌的靶向治疗探索至今仍然成果寥寥,但各种新技术、新理念,尤其是从表观遗传和代谢组学角度开展的探索,不仅有望打破靶向治疗僵局、助力现有的免疫治疗,还可能为其它部位鳞状细胞癌的精准治疗带来深远的影响,这就需要未来科学家们和临床工作者多多努力了。
参考文献:
[1]Lau S C M, Pan Y, Velcheti V, et al. Squamous cell lung cancer: Current landscape and future therapeutic options[J]. Cancer Cell, 2022.
[2]Redman M W, Papadimitrakopoulou V A, Minichiello K, et al. Biomarker-driven therapies for previously treated squamous non-small-cell lung cancer (Lung-MAP SWOG S1400): a biomarker-driven master protocol[J]. The Lancet Oncology, 2020, 21(12): 1589-1601.
[3]Best S A, Gubser P M, Sethumadhavan S, et al. Glutaminase inhibition impairs CD8 T cell activation in STK11-/Lkb1-deficient lung cancer[J]. Cell metabolism, 2022, 34(6): 874-887.
[4]Stewart P A, Welsh E A, Slebos R J C, et al. Proteogenomic landscape of squamous cell lung cancer[J]. Nature communications, 2019, 10: 3578.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


